मैग्नीशियम आयन इंसुलिन के हीमोग्लोबिन का हिस्सा हैं। अस्थि ऊतक के खनिज और कार्बनिक घटकों में उम्र से संबंधित परिवर्तन। जब एक गर्भवती महिला को मैग्नीशियम की तैयारी निर्धारित की जाती है। मैग्नीशियम और इसकी विविध क्रिया मैग्नीशियम किसका हिस्सा है
इन तत्वों का अध्ययन करने वाला विज्ञान रसायन विज्ञान है। आवर्त सारणी, जिसके आधार पर आप इस विज्ञान का अध्ययन कर सकते हैं, हमें दिखाती है कि मैग्नीशियम परमाणु में बारह प्रोटॉन और न्यूट्रॉन होते हैं। इसे क्रम संख्या द्वारा निर्धारित किया जा सकता है (यह प्रोटॉन की संख्या के बराबर है, और यदि यह एक तटस्थ परमाणु है, आयन नहीं तो इलेक्ट्रॉनों की संख्या समान होगी)।
मैग्नीशियम की रासायनिक विशेषताओं का अध्ययन रसायन विज्ञान द्वारा भी किया जाता है। उनके विचार के लिए आवर्त सारणी भी आवश्यक है, क्योंकि यह हमें तत्व की वैधता दिखाती है (इस मामले में, यह दो के बराबर है)। यह इस बात पर निर्भर करता है कि परमाणु किस समूह से संबंधित है। इसके अलावा, इसकी मदद से आप यह पता लगा सकते हैं कि मैग्नीशियम का दाढ़ द्रव्यमान चौबीस है। यानी इस धातु के एक मोल का वजन चौबीस ग्राम होता है। मैग्नीशियम का सूत्र बहुत सरल है - इसमें अणु नहीं होते हैं, बल्कि क्रिस्टल जाली द्वारा एकजुट परमाणु होते हैं।
भौतिकी की दृष्टि से मैग्नीशियम के लक्षण
पारा को छोड़कर सभी धातुओं की तरह, इस यौगिक में सामान्य परिस्थितियों में एकत्रीकरण की एक ठोस अवस्था होती है। इसमें एक अजीब चमक के साथ हल्का भूरा रंग है। इस धातु में काफी अधिक ताकत होती है। मैग्नीशियम की भौतिक विशेषताएं यहीं समाप्त नहीं होती हैं।
गलनांक और क्वथनांक पर विचार करें। पहला छह सौ पचास डिग्री सेल्सियस के बराबर है, दूसरा एक हजार नब्बे डिग्री सेल्सियस के बराबर है। इससे यह निष्कर्ष निकाला जा सकता है कि यह काफी कम पिघलने वाली धातु है। इसके अलावा, यह बहुत हल्का है: इसका घनत्व 1.7 ग्राम/सेमी3 है।
मैग्नीशियम. रसायन विज्ञान
इस पदार्थ की भौतिक विशेषताओं को जानने के बाद, हम इसकी विशेषताओं के दूसरे भाग की ओर आगे बढ़ सकते हैं। इस धातु में गतिविधि का औसत स्तर होता है। इसे धातुओं की विद्युत रासायनिक श्रृंखला से देखा जा सकता है - यह जितना अधिक निष्क्रिय होता है, यह उतना ही अधिक दाईं ओर होता है। मैग्नीशियम बाईं ओर सबसे पहले में से एक है। क्रम से विचार करें कि यह किन पदार्थों के साथ प्रतिक्रिया करता है और यह कैसे होता है।
सरल के साथ
इनमें वे शामिल हैं जिनके अणुओं में केवल एक रासायनिक तत्व होता है। यह ऑक्सीजन, और फिस्फोरस, और सल्फर, और कई अन्य हैं। आइए सबसे पहले ऑक्सीजन के साथ अंतःक्रिया पर विचार करें। इसे दहन कहते हैं. ऐसे में इस धातु का ऑक्साइड बनता है। यदि आप दो मोल मैग्नीशियम जलाते हैं, जबकि एक मोल ऑक्सीजन खर्च करते हैं, तो हमें दो मोल ऑक्साइड प्राप्त होता है। इस प्रतिक्रिया का समीकरण इस प्रकार लिखा गया है: 2Mg + O 2 = 2MgO. इसके अलावा, जब मैग्नीशियम को खुली हवा में जलाया जाता है, तो इसका नाइट्राइड भी बनता है, क्योंकि यह धातु वायुमंडल में मौजूद नाइट्रोजन के साथ समानांतर रूप से प्रतिक्रिया करती है।
तीन मोल मैग्नीशियम को जलाने पर, एक मोल नाइट्रोजन खर्च होता है, और परिणामस्वरूप हमें संबंधित धातु का एक मोल नाइट्राइड प्राप्त होता है। इस प्रकार की रासायनिक अंतःक्रिया का समीकरण इस प्रकार लिखा जा सकता है: 3Mg + N 2 = Mg 3 N 2.

इसके अलावा, मैग्नीशियम हैलोजन जैसे अन्य सरल पदार्थों के साथ प्रतिक्रिया करने में सक्षम है। उनके साथ अंतःक्रिया तभी होती है जब घटकों को बहुत उच्च तापमान पर गर्म किया जाता है। इस स्थिति में, एक अतिरिक्त प्रतिक्रिया होती है। हैलोजन में ऐसे सरल पदार्थ शामिल हैं: क्लोरीन, आयोडीन, ब्रोमीन, फ्लोरीन। और प्रतिक्रियाओं को तदनुसार नाम दिया गया है: क्लोरीनीकरण, आयोडीनीकरण, ब्रोमिनेशन, फ्लोरिनेशन। जैसा कि आपने अनुमान लगाया होगा, ऐसी अंतःक्रियाओं के परिणामस्वरूप, आप क्लोराइड, आयोडाइड, ब्रोमाइड, मैग्नीशियम फ्लोराइड प्राप्त कर सकते हैं। उदाहरण के लिए, यदि हम एक मोल मैग्नीशियम और उतनी ही मात्रा में आयोडीन लेते हैं, तो हमें इस धातु का एक मोल आयोडाइड मिलता है। इस रासायनिक प्रतिक्रिया को निम्नलिखित समीकरण का उपयोग करके व्यक्त किया जा सकता है: एमजी + आई 2 = एमजीआई 2। यही सिद्धांत क्लोरीनीकरण पर भी लागू होता है। यहां प्रतिक्रिया समीकरण है: एमजी + सीएल 2 = एमजीसीएल 2।
इसके अलावा, मैग्नीशियम समेत धातुएं फॉस्फोरस और सल्फर के साथ प्रतिक्रिया करती हैं। पहले मामले में, आप फॉस्फाइड प्राप्त कर सकते हैं, दूसरे में - सल्फाइड (फॉस्फेट और सल्फेट्स के साथ भ्रमित न हों!)। यदि आप तीन मोल मैग्नीशियम लेते हैं, उसमें दो मोल फास्फोरस मिलाते हैं और इसे वांछित तापमान तक गर्म करते हैं, तो संबंधित धातु का एक मोल फॉस्फाइड बनता है। इस रासायनिक प्रतिक्रिया का समीकरण इस प्रकार है: 3Mg + 2P = Mg 3 P 2. इसी प्रकार, यदि हम मैग्नीशियम और सल्फर को समान दाढ़ अनुपात में मिलाते हैं और उच्च तापमान के रूप में आवश्यक परिस्थितियाँ बनाते हैं, तो हमें इस धातु का सल्फाइड मिलता है। ऐसी रासायनिक अंतःक्रिया के लिए समीकरण इस प्रकार लिखा जा सकता है: Mg + S = MgS। इसलिए हमने अन्य सरल पदार्थों के साथ इस धातु की प्रतिक्रियाओं की जांच की। लेकिन मैग्नीशियम का रासायनिक लक्षण वर्णन यहीं समाप्त नहीं होता है।
जटिल यौगिकों के साथ प्रतिक्रियाएँ
इन पदार्थों में पानी, लवण, अम्ल शामिल हैं। धातुएँ अलग-अलग समूहों के साथ अलग-अलग प्रतिक्रिया करती हैं। आइए हर चीज़ पर क्रम से विचार करें।
मैग्नीशियम और पानी
जब यह धातु पृथ्वी पर सबसे आम रासायनिक यौगिक के साथ संपर्क करती है, तो तेज अप्रिय गंध के साथ ऑक्साइड और हाइड्रोजन गैस के रूप में बनते हैं। इस प्रकार की प्रतिक्रिया को अंजाम देने के लिए घटकों को भी गर्म करने की आवश्यकता होती है। यदि आप एक मोल मैग्नीशियम और पानी मिलाते हैं, तो आपको समान मात्रा में ऑक्साइड और हाइड्रोजन मिलते हैं। प्रतिक्रिया समीकरण इस प्रकार लिखा गया है: Mg + H 2 O = MgO + H 2।
अम्लों के साथ अंतःक्रिया
अन्य प्रतिक्रियाशील धातुओं की तरह, मैग्नीशियम अपने यौगिकों से हाइड्रोजन परमाणुओं को विस्थापित करने में सक्षम है। ऐसी प्रक्रियाओं को कहा जाता है ऐसे मामलों में, धातु परमाणु हाइड्रोजन परमाणुओं को प्रतिस्थापित करते हैं और मैग्नीशियम (या अन्य तत्व) और एक एसिड अवक्षेप से युक्त नमक बनाते हैं। उदाहरण के लिए, यदि आप एक मोल मैग्नीशियम लेते हैं और इसे दो मोल की मात्रा में मिलाते हैं, तो संबंधित धातु का एक मोल क्लोराइड और उतनी ही मात्रा में हाइड्रोजन बनता है। प्रतिक्रिया समीकरण इस तरह दिखेगा: Mg + 2HCl = MgCl 2 + H 2.
नमक की परस्पर क्रिया
हम पहले ही बता चुके हैं कि अम्ल से लवण कैसे बनते हैं, लेकिन रसायन विज्ञान की दृष्टि से मैग्नीशियम के लक्षण वर्णन में लवण के साथ इसकी प्रतिक्रियाओं पर विचार करना भी शामिल है। इस मामले में, परस्पर क्रिया तभी हो सकती है जब नमक का हिस्सा धातु मैग्नीशियम से कम सक्रिय हो। उदाहरण के लिए, यदि हम मैग्नीशियम और कॉपर सल्फेट प्रत्येक का एक मोल लेते हैं, तो हमें संबंधित धातु का सल्फेट और समान दाढ़ अनुपात में शुद्ध तांबा मिलता है। इस प्रकार की प्रतिक्रिया के लिए समीकरण इस प्रकार लिखा जा सकता है: Mg + CuSO 4 = MgSO 4 + Cu। यहीं पर मैग्नीशियम के कम करने वाले गुण काम में आते हैं।

इस धातु का अनुप्रयोग
इस तथ्य के कारण कि यह कई मामलों में एल्यूमीनियम से बेहतर है - यह लगभग तीन गुना हल्का है, लेकिन साथ ही दोगुना मजबूत है, यह विभिन्न उद्योगों में व्यापक हो गया है। सबसे पहले, यह विमान उद्योग है। यहां, उपयोग की जाने वाली सभी सामग्रियों के बीच लोकप्रियता में मैग्नीशियम-आधारित मिश्र धातुएं पहले स्थान पर हैं। इसके अलावा, इसका उपयोग रासायनिक उद्योग में कुछ धातुओं को उनके यौगिकों से निकालने के लिए एक कम करने वाले एजेंट के रूप में किया जाता है। इस तथ्य के कारण कि मैग्नीशियम जलने पर बहुत शक्तिशाली फ्लैश बनाता है, इसका उपयोग सैन्य उद्योग में सिग्नल फ्लेयर्स, फ्लैश-शोर गोला-बारूद आदि के निर्माण के लिए किया जाता है।
मैग्नीशियम प्राप्त करना
इसके लिए मुख्य कच्चा माल संबंधित धातु का क्लोराइड है। यह इलेक्ट्रोलिसिस द्वारा किया जाता है।
किसी दिए गए धातु के धनायनों की गुणात्मक प्रतिक्रिया
यह किसी पदार्थ के आयनों की उपस्थिति निर्धारित करने के लिए डिज़ाइन की गई एक विशेष प्रक्रिया है। मैग्नीशियम यौगिकों की उपस्थिति का परीक्षण करने के लिए घोल में पोटेशियम या सोडियम कार्बोनेट मिलाया जा सकता है। परिणामस्वरूप, एक सफेद अवक्षेप बनता है, जो एसिड में आसानी से घुलनशील होता है।
यह धातु प्रकृति में कहाँ पाई जा सकती है?
यह रासायनिक तत्व प्रकृति में काफी सामान्य है। पृथ्वी की पपड़ी लगभग दो प्रतिशत इसी धातु से बनी है। यह कई खनिजों की संरचना में पाया जाता है, जैसे कार्नेलाइट, मैग्नेसाइट, डोलोमाइट, टैल्क, एस्बेस्टस। पहले खनिज का सूत्र इस तरह दिखता है: KCl.MgCl 2 .6H 2 O. यह नीले, हल्के गुलाबी, फीके लाल, हल्के पीले या पारदर्शी क्रिस्टल जैसा दिखता है।

मैग्नेसाइट इसका रासायनिक सूत्र है - MgCO3. इसका रंग सफेद है, लेकिन अशुद्धियों के आधार पर इसका रंग भूरा, भूरा या पीला हो सकता है। डोलोमाइट का रासायनिक सूत्र निम्नलिखित है: MgCO 3 .CaCO 3। यह एक पीला-भूरा या कांच जैसा खनिज है।
टैल्क और एस्बेस्टस के अधिक जटिल सूत्र हैं: क्रमशः 3MgO.4SiO 2 .H 2 O और 3MgO.2SiO 2 .2H 2 O। उनके उच्च ताप प्रतिरोध के कारण, उनका उद्योग में व्यापक रूप से उपयोग किया जाता है। इसके अलावा, मैग्नीशियम कोशिका की रासायनिक संरचना और कई कार्बनिक पदार्थों की संरचना में शामिल है। हम इस पर अधिक विस्तार से विचार करेंगे।
शरीर में मैग्नीशियम की भूमिका
यह रासायनिक तत्व पौधे और पशु प्राणियों दोनों के लिए महत्वपूर्ण है। मैग्नीशियम पौधे के जीव के लिए महत्वपूर्ण है। जिस प्रकार लौह हीमोग्लोबिन का आधार है, जो जानवरों के जीवन के लिए आवश्यक है, उसी प्रकार मैग्नीशियम क्लोरोफिल का मुख्य घटक है, जिसके बिना एक पौधे का अस्तित्व नहीं हो सकता। यह वर्णक प्रकाश संश्लेषण की प्रक्रिया में शामिल होता है, जिसमें पत्तियों में अकार्बनिक यौगिकों से पोषक तत्वों का संश्लेषण होता है।

मैग्नीशियम जानवरों के शरीर के लिए भी बहुत जरूरी है। कोशिका में इस ट्रेस तत्व का द्रव्यमान अंश 0.02-0.03% है। इस तथ्य के बावजूद कि यह इतना छोटा है, यह बहुत महत्वपूर्ण कार्य करता है। इसके लिए धन्यवाद, माइटोकॉन्ड्रिया जैसे जीवों की संरचना, जो सेलुलर श्वसन और ऊर्जा संश्लेषण के लिए जिम्मेदार हैं, साथ ही राइबोसोम, जिसमें जीवन के लिए आवश्यक प्रोटीन बनते हैं, बनाए रखा जाता है। इसके अलावा, यह कई एंजाइमों की रासायनिक संरचना में शामिल है जो इंट्रासेल्युलर चयापचय और डीएनए संश्लेषण के लिए आवश्यक हैं।
संपूर्ण शरीर के लिए, ग्लूकोज, वसा और कुछ अमीनो एसिड के चयापचय में भाग लेने के लिए मैग्नीशियम आवश्यक है। साथ ही, इस सूक्ष्म तत्व की मदद से एक तंत्रिका संकेत प्रसारित किया जा सकता है। उपरोक्त सभी के अलावा, शरीर में पर्याप्त मैग्नीशियम दिल के दौरे, दिल के दौरे और स्ट्रोक के जोखिम को कम करता है।
मानव शरीर में उच्च और निम्न स्तर के लक्षण
शरीर में मैग्नीशियम की कमी उच्च रक्तचाप, थकान और खराब प्रदर्शन, चिड़चिड़ापन और खराब नींद, स्मृति हानि और बार-बार चक्कर आना जैसे मुख्य लक्षणों से प्रकट होती है। मतली, ऐंठन, उंगलियों में कांपना, चेतना का भ्रम भी देखा जा सकता है - ये भोजन के साथ इस सूक्ष्म तत्व के बहुत कम सेवन के संकेत हैं।

शरीर में मैग्नीशियम की कमी से बार-बार श्वसन संबंधी बीमारियाँ, हृदय प्रणाली में विकार और साथ ही टाइप 2 मधुमेह होता है। इसके बाद, खाद्य पदार्थों में मैग्नीशियम की मात्रा पर विचार करें। इसकी कमी से बचने के लिए आपको यह जानना जरूरी है कि कौन सा भोजन इस रासायनिक तत्व से भरपूर है। यह भी ध्यान में रखा जाना चाहिए कि इनमें से कई लक्षण विपरीत स्थिति में भी प्रकट हो सकते हैं - शरीर में मैग्नीशियम की अधिकता, साथ ही पोटेशियम और सोडियम जैसे ट्रेस तत्वों की कमी। इसलिए, अपने आहार की सावधानीपूर्वक समीक्षा करना और समस्या के सार को समझना महत्वपूर्ण है, पोषण विशेषज्ञ की मदद से ऐसा करना सबसे अच्छा है।
जैसा कि ऊपर बताया गया है, यह तत्व क्लोरोफिल का मुख्य घटक है। इसलिए, आप अनुमान लगा सकते हैं कि इसकी एक बड़ी मात्रा साग में पाई जाती है: ये अजवाइन, डिल, अजमोद, फूलगोभी और सफेद गोभी, सलाद, आदि हैं। इसके अलावा, ये कई अनाज हैं, विशेष रूप से एक प्रकार का अनाज और बाजरा, और दलिया और जौ भी हैं। . इसके अलावा, नट्स इस ट्रेस तत्व से भरपूर होते हैं: ये हैं काजू, अखरोट, मूंगफली, हेज़लनट्स और बादाम। इसके अलावा, प्रश्न में धातु की एक बड़ी मात्रा सेम और मटर जैसी फलियां में पाई जाती है।

इसका बहुत सारा हिस्सा शैवाल की संरचना में भी निहित है, उदाहरण के लिए, समुद्री शैवाल में। यदि इन उत्पादों का उपयोग सामान्य मात्रा में किया जाए तो आपके शरीर में इस लेख में बताई गई धातु की कमी नहीं होगी। यदि आपके पास ऊपर सूचीबद्ध भोजन को नियमित रूप से खाने का अवसर नहीं है, तो ऐसे पोषक तत्वों की खुराक खरीदना सबसे अच्छा है जिसमें यह ट्रेस तत्व शामिल हो। हालाँकि, ऐसा करने से पहले आपको हमेशा अपने डॉक्टर से सलाह लेनी चाहिए।
निष्कर्ष
मैग्नीशियम दुनिया की सबसे महत्वपूर्ण धातुओं में से एक है। इसे कई उद्योगों में व्यापक अनुप्रयोग मिला है - रसायन से लेकर विमानन और सैन्य तक। इसके अलावा, यह जैविक दृष्टिकोण से भी बहुत महत्वपूर्ण है। इसके बिना न तो पौधे और न ही पशु जीवों का अस्तित्व संभव है। इस रासायनिक तत्व के लिए धन्यवाद, वह प्रक्रिया जो पूरे ग्रह को जीवन देती है, प्रकाश संश्लेषण, संपन्न होती है।
परिभाषा
मैगनीशियम- आवर्त सारणी का बारहवाँ तत्व। पदनाम - लैटिन "मैग्नीशियम" से एमजी। तीसरी अवधि में स्थित, समूह IIA। धातुओं को संदर्भित करता है. परमाणु चार्ज 12 है.
मैग्नीशियम प्रकृति में बहुत आम है। यह बड़ी मात्रा में मैग्नीशियम कार्बोनेट के रूप में होता है, जिससे खनिज मैग्नेसाइट एमजीसीओ 3 और डोलोमाइट एमजीसीओ 3 × सीएसीओ 3 बनता है। सल्फेट और मैग्नीशियम क्लोराइड, केनाइट KCl × MgSO 4 × 3H 2 O और कार्नेलाइट KCl × MgCl 2 × 6H 2 O खनिजों का हिस्सा हैं। Mg 2+ आयन समुद्र के पानी में पाया जाता है, जिससे इसका स्वाद कड़वा हो जाता है। पृथ्वी की पपड़ी में मैग्नीशियम की कुल मात्रा लगभग 2% (wt.) है।
एक साधारण पदार्थ के रूप में, मैग्नीशियम एक चांदी जैसा सफेद (चित्र 1) है, जो एक बहुत हल्की धातु है। हवा में, यह थोड़ा बदलता है, क्योंकि यह जल्दी से ऑक्साइड की एक पतली परत से ढक जाता है, जो इसे आगे ऑक्सीकरण से बचाता है।
चावल। 1. मैग्नीशियम. उपस्थिति।
मैग्नीशियम का परमाणु और आणविक भार
किसी पदार्थ का सापेक्ष आणविक भार (एम आर) एक संख्या है जो दर्शाती है कि किसी दिए गए अणु का द्रव्यमान कार्बन परमाणु के द्रव्यमान के 1/12 से कितनी गुना अधिक है, और किसी तत्व का सापेक्ष परमाणु द्रव्यमान (एआर आर) किसी रासायनिक तत्व के परमाणुओं का औसत द्रव्यमान कार्बन परमाणु के द्रव्यमान के 1/12 से कितनी गुना अधिक है।
चूँकि मुक्त अवस्था में मैग्नीशियम एकपरमाण्विक एमजी अणुओं के रूप में मौजूद होता है, इसलिए इसके परमाणु और आणविक द्रव्यमान का मान समान होता है। वे 24.304 के बराबर हैं।
मैग्नीशियम के समस्थानिक
यह ज्ञात है कि मैग्नीशियम प्रकृति में तीन स्थिर आइसोटोप 24 एमजी (23.99%), 25 एमजी (24.99%) और 26 एमजी (25.98%) के रूप में हो सकता है। इनकी द्रव्यमान संख्याएँ क्रमशः 24, 25 और 26 हैं। मैग्नीशियम आइसोटोप 24 एमजी के परमाणु के नाभिक में बारह प्रोटॉन और बारह न्यूट्रॉन होते हैं, और आइसोटोप 25 एमजी और 26 एमजी में क्रमशः प्रोटॉन, तेरह और चौदह न्यूट्रॉन की समान संख्या होती है।
मैग्नीशियम के कृत्रिम समस्थानिक होते हैं जिनकी द्रव्यमान संख्या 5 से 23 और 27 से 40 तक होती है।
मैग्नीशियम आयन
मैग्नीशियम परमाणु के बाहरी ऊर्जा स्तर पर, दो इलेक्ट्रॉन होते हैं जो वैलेंस होते हैं:
1s 2 2s 2 2p 6 3s 2।
रासायनिक अंतःक्रिया के परिणामस्वरूप, मेनियम अपने वैलेंस इलेक्ट्रॉनों को छोड़ देता है, अर्थात। उनका दाता है, और एक सकारात्मक रूप से चार्ज आयन में बदल जाता है:
एमजी 0 -2ई → एमजी 2+।
मैग्नीशियम अणु और परमाणु
मुक्त अवस्था में, मैग्नीशियम मोनोएटोमिक एमजी अणुओं के रूप में मौजूद होता है। यहां कुछ गुण दिए गए हैं जो मैग्नीशियम परमाणु और अणु की विशेषता बताते हैं:
मैग्नीशियम मिश्र धातु
धात्विक मैग्नीशियम के अनुप्रयोग का मुख्य क्षेत्र इसके आधार पर विभिन्न प्रकाश मिश्र धातुओं का उत्पादन है। मैग्नीशियम में अन्य धातुओं की थोड़ी मात्रा मिलाने से इसके यांत्रिक गुणों में नाटकीय रूप से परिवर्तन होता है, जिससे मिश्र धातु को महत्वपूर्ण कठोरता, ताकत और संक्षारण प्रतिरोध मिलता है।
इलेक्ट्रॉन नामक मिश्र धातु में विशेष रूप से मूल्यवान गुण होते हैं। वे तीन प्रणालियों से संबंधित हैं: Mg-Al-Zn, Mg-Mn और Mg-Zn-Zr। सबसे व्यापक रूप से उपयोग किए जाने वाले एमजी-अल-जेडएन प्रणाली के मिश्र धातु हैं, जिनमें 3 से 10% एल्यूमीनियम और 0.2 से 3% जस्ता होता है। मैग्नीशियम मिश्र धातुओं का लाभ उनका कम घनत्व (लगभग 1.8 ग्राम/सेमी3) है।
समस्या समाधान के उदाहरण
उदाहरण 1
यह सब प्रकाश संश्लेषण से शुरू हुआ। यह जानना दिलचस्प है कि हमारे शरीर के लिए मैग्नीशियम के महत्व और इसकी कमी के परिणामों का आकलन उसी समय शुरू हुआ जब पौधे प्रकाश संश्लेषण के रहस्यों की खोज की गई - बस कुछ दशक पहले।
कार्बनिक पदार्थों के निरंतर निर्माण की प्रक्रिया अरबों साल पहले शुरू हुई, जब पृथ्वी पर वर्णक प्रकट हुए, जो सूर्य के प्रकाश को अवशोषित करके रासायनिक प्रतिक्रियाएँ पैदा करते थे। इसमें निर्णायक भूमिका सरल यौगिकों से बने समूह के "प्रकाश संवेदनशील" पदार्थों - और ग्लिसरॉल द्वारा निभाई गई थी। हालाँकि, क्लोरोफिल के रूप में पोर्फिरिन के मैग्नीशियम व्युत्पन्न की उपस्थिति के साथ ही जैविक जीवन के उच्च रूपों का प्राकृतिक इतिहास शुरू हुआ। क्लोरोफिल में एक अपरिवर्तनीय फोटोकैमिकल प्रतिक्रिया करने की क्षमता होती है, जिसकी ऊर्जा स्थिर जैव रासायनिक यौगिकों में जमा होती है।
प्रकाश संश्लेषण की प्रक्रिया संभवतः प्रीकैम्ब्रियन काल के अंत में (लगभग 1000 मिलियन वर्ष पहले) आकार ले चुकी थी। क्लोरोफिल की संरचना रक्त वर्णक के मुख्य घटक हीम की संरचना के बहुत करीब है। अंतर यह है कि क्लोरोफिल में मैग्नीशियम (मैग्नीशियम आयन), और हीम, हीमोग्लोबिन - (लौह आयन) होता है। जगियेलोनियन विश्वविद्यालय के प्रोफेसर लियोन मार्कलेव्स्की की इस खोज ने वनस्पतियों और जीवों के विकास के बीच संबंध की पुष्टि की।
जब मिट्टी में मैग्नीशियम की मात्रा कम होती है तो पौधे मुरझा जाते हैं, वे धीरे-धीरे बढ़ते हैं, उनकी पत्तियाँ पीली हो जाती हैं और समय से पहले पीली हो जाती हैं। मिट्टी में मैग्नीशियम लवण मिलाने से पौधे पूरी तरह से "" वापस आ जाते हैं।
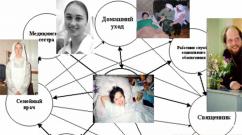
हम कह सकते हैं कि एक व्यक्ति के साथ भी ऐसा ही होता है, हालाँकि... सब कुछ बहुत अधिक जटिल है। यदि भोजन में पर्याप्त मात्रा में मैग्नीशियम न हो तो व्यक्ति स्वस्थ नहीं रह सकता। मैग्नीशियम की कमी से होने वाली बीमारियों पर पहली कांग्रेस के प्रतिभागी इस निष्कर्ष पर पहुंचे। कांग्रेस मई 1971 में विट्टेल में आयोजित की गई थी। मैग्नीशियम आयन शरीर में होने वाली लगभग सभी प्रक्रियाओं में एक विशेष भूमिका निभाता है। तो, प्रतिरक्षा प्रक्रियाओं में, यह तनाव-विरोधी, एंटी-टॉक्सिक, एंटी-एलर्जी, एंटी-एनाफिलेक्टिक (संवेदनशीलता का प्रकार), एंटी-इंफ्लेमेटरी, आयनकारी विकिरण से बचाने, तापमान को नियंत्रित करने, उत्तेजक और निर्माण में भाग लेने के रूप में कार्य करता है। एंटीबॉडी का. मैग्नीशियम का आरामदायक प्रभाव होता है और यह शरीर की संवेदनशीलता को कम करता है। तभी, विटेल में कांग्रेस में, प्रोफेसर ड्यूर्लाच ने कहा: "आधुनिक सभ्य दुनिया का संकेत मैग्नीशियम आयन का लगातार घटता स्तर है।"
ऐसा प्रतीत होता है कि सभ्यता की बीमारियाँ मुख्यतः मानव शरीर में मैग्नीशियम की कमी के कारण होती हैं। इसलिए मैग्नीशियम पर करीब से नज़र डालना उचित है।
हमें मैग्नीशियम मिट्टी से मिलता है - पौधों पर आधारित खाद्य पदार्थों और पौधे खाने वाले जानवरों से प्राप्त खाद्य पदार्थों के माध्यम से। इसलिए हमारे शरीर में उतना ही मैग्नीशियम प्रवेश करता है जितना मिट्टी में होता है।
इस बीच, मिट्टी में मैग्नीशियम बहुत कम है। पोलिश भूमि के 40% में मैग्नीशियम की कमी देखी गई है, 34% भूमि में औसत सामग्री, और 26% से कम में पर्याप्त या उच्च सामग्री है। कृत्रिम उर्वरक या तो मिट्टी को मैग्नीशियम से बिल्कुल भी समृद्ध नहीं करते हैं, या उसे इसकी बहुत कम मात्रा प्राप्त होती है। उदाहरण के लिए, 1971-1975 में। पोलिश भूमि में जोड़े गए मैग्नीशियम की औसत मात्रा प्रति 1 हेक्टेयर खेती योग्य भूमि में 10-12 किलोग्राम मैग्नीशियम ऑक्साइड (एमजीओ) थी। क्या यह बहुत है या थोड़ा? 40 क्विंटल/हेक्टेयर उपज वाले गेहूं को 1 हेक्टेयर एमजीओ के साथ लगभग 17 किलोग्राम मिट्टी से प्राप्त होना चाहिए, और केवल 350 क्विंटल/हेक्टेयर उपज वाले चुकंदर से लगभग 66 किलोग्राम प्राप्त होना चाहिए।
बेशक, आवश्यक मैग्नीशियम उर्वरक की मात्रा मिट्टी की मैग्नीशियम सामग्री और उगाई जाने वाली फसल के प्रकार पर निर्भर करती है। आमतौर पर यह 130 से 260 किलोग्राम/हेक्टेयर तक होता है। कीसेराइट (मैग्नीशियम उर्वरक) की इस मात्रा से, 30-60 किलोग्राम मैग्नीशियम ऑक्साइड और इसके अलावा, 15-31 किलोग्राम पोटेशियम ऑक्साइड मिट्टी में चला जाता है। खाद में 0.18% मैग्नीशियम होता है, जिसका अर्थ है कि यदि हम प्रति 1 हेक्टेयर में 300 किलोग्राम खाद डालते हैं, तो हमें लगभग 54 किलोग्राम मिलीग्राम मिलता है। यह निश्चित रूप से पर्याप्त नहीं है.
क्लोरोफिल में 2.7% मैग्नीशियम होता है। मैग्नीशियम आयन कोशिका जलयोजन की डिग्री को नियंत्रित करते हैं। पौधों में मैग्नीशियम की कमी के साथ, पानी के वाष्पीकरण की प्रक्रिया सीमित होती है, और अधिक होने पर, पौधे तीव्रता से पानी को अवशोषित करते हैं, जिससे जड़ प्रणाली के भीतर मिट्टी सूख जाती है।
रुचि रखने वालों के लिए, यहां एक तालिका है।
यह एक प्राकृतिक ट्रैंक्विलाइज़र और तनाव-विरोधी खनिज है!
मैग्नीशियम प्रकृति में सबसे आम तत्वों में से एक है, यह मनुष्यों और जानवरों में हड्डियों और दाँत तामचीनी का एक अभिन्न अंग है, और पौधों में यह क्लोरोफिल का हिस्सा है। पीने के पानी में मैग्नीशियम आयन पाए जाते हैं और समुद्र के पानी में बहुत अधिक मात्रा में मैग्नीशियम क्लोराइड होता है।
शरीर में 20-30 ग्राम मैग्नीशियम होता है। लगभग 1% मैग्नीशियम शरीर के तरल पदार्थों में पाया जाता है, जबकि शेष 99% हड्डी (लगभग 40%) और कोमल ऊतकों (लगभग 59%) में पाया जाता है।
मैग्नीशियम से भरपूर खाद्य पदार्थ
उत्पाद की 100 ग्राम में अनुमानित उपलब्धता
मैग्नीशियम की दैनिक आवश्यकता 400-500 मिलीग्राम है।
मैग्नीशियम की आवश्यकता बढ़ जाती है:
- तनाव;
- आहार में बड़ी मात्रा में प्रोटीन की सामग्री;
- नए ऊतकों का तेजी से निर्माण - बच्चों, बॉडी बिल्डरों में;
- गर्भावस्था और स्तनपान;
- मूत्रवर्धक लेना।
पाचनशक्ति
मैग्नीशियम मुख्य रूप से ग्रहणी में और थोड़ा बड़ी आंत में अवशोषित होता है। लेकिन केवल कार्बनिक मैग्नीशियम यौगिक ही अच्छी तरह से अवशोषित होते हैं, उदाहरण के लिए, अमीनो एसिड, कार्बनिक अम्ल (मैग्नीशियम लैक्टेट, मैग्नीशियम साइट्रेट) आदि के साथ परिसरों की संरचना में कार्बनिक मैग्नीशियम यौगिक। अकार्बनिक लवण (मैग्नीशियम सल्फेट) बहुत खराब अवशोषित होते हैं।
शरीर में कैल्शियम (Ca), फास्फोरस (P), सोडियम (Na), वसा का अत्यधिक सेवन मैग्नीशियम के अवशोषण को ख़राब करता है। आहार फाइबर मैग्नीशियम को बांधता है, और अतिरिक्त शराब, कैफीन और पोटेशियम (K) मूत्र में मैग्नीशियम की हानि को बढ़ाते हैं।
मैग्नीशियम के उपयोगी गुण और शरीर पर इसका प्रभाव
मैग्नीशियम शरीर में एक महत्वपूर्ण भूमिका निभाता है - यह लगभग 300 एंजाइमों के सामान्य कामकाज के लिए आवश्यक है। कैल्शियम (Ca) और फास्फोरस (P) के साथ, मैग्नीशियम स्वस्थ हड्डियों के निर्माण में शामिल होता है।
मैग्नीशियम ग्लूकोज, अमीनो एसिड, वसा के चयापचय, पोषक तत्वों के परिवहन और ऊर्जा उत्पादन के लिए आवश्यक है। मैग्नीशियम प्रोटीन संश्लेषण, आनुवंशिक जानकारी के संचरण, तंत्रिका संकेतों की प्रक्रिया में शामिल है। स्वस्थ हृदय प्रणाली को बनाए रखने के लिए आवश्यक। पर्याप्त मैग्नीशियम का स्तर दिल के दौरे की संभावना को कम करता है।
मैग्नीशियम मांसपेशियों की गतिविधि को सामान्य करता है, कोलेस्ट्रॉल को कम करता है, कुछ प्रकार के विषाक्त पदार्थों के शरीर को साफ करने में मदद करता है।
मैग्नीशियम विटामिन बी6 (पाइरिडोक्सिन) के साथ मिलकर गुर्दे की पथरी के निर्माण को रोकता है। यदि केवल मैग्नीशियम की कमी है, तो गुर्दे की पथरी अक्सर फॉस्फेट (फॉस्फोरस के साथ कैल्शियम यौगिक) होती है, और यदि केवल विटामिन बी 6 की कमी होती है, तो ऑक्सालेट पथरी दिखाई देती है (ऑक्सालिक एसिड के साथ कैल्शियम (सीए) यौगिक)।
वह के रूप में जाना जाता है तनावरोधी पदार्थ- मैग्नीशियम की अतिरिक्त मात्रा तनाव के प्रति प्रतिरोधक क्षमता बढ़ाने में योगदान करती है। मैग्नीशियम लवण घातक ट्यूमर के विकास को रोकता है।
मैग्नीशियम अधिक काम के खिलाफ लड़ाई में भी मदद करता है - क्रोनिक ओवरवर्क के लिए मैग्नीशियम युक्त पूरक का उपयोग करने की सिफारिश की जाती है।
अन्य आवश्यक तत्वों के साथ सहभागिता
सोडियम (Na) और फास्फोरस (P) के साथ मैग्नीशियम शरीर की मांसपेशियों और तंत्रिका गतिविधि में शामिल होता है। विटामिन डी मैग्नीशियम चयापचय को नियंत्रित करता है, जिससे इसकी क्रिया की प्रभावशीलता बढ़ जाती है। विटामिन ई, विटामिन बी6 और पोटेशियम (K) भी मैग्नीशियम चयापचय में सुधार करते हैं। मैग्नीशियम की कमी से कोशिकाओं के अंदर पोटेशियम (K) बरकरार नहीं रह पाता है।
मानव शरीर में कैल्शियम और मैग्नीशियम एक दूसरे के साथ एक निश्चित अनुपात में होने चाहिए। ऐसा माना जाता है कि यह अनुपात 1:0.6 से अधिक नहीं होना चाहिए। तो, मैग्नीशियम की कमी के साथ, मूत्र में कैल्शियम खो जाएगा, और अतिरिक्त कैल्शियम, बदले में, मैग्नीशियम की कमी का कारण बनता है।
मैग्नीशियम की कमी और अधिकता
मैग्नीशियम की कमी के लक्षण
- अनिद्रा, सुबह की थकान (लंबी नींद के बाद भी);
- चिड़चिड़ापन, शोर के प्रति संवेदनशीलता में वृद्धि, असंतोष;
- चक्कर आना, संतुलन की हानि;
- आंखों के सामने टिमटिमाते बिंदुओं का दिखना;
- रक्तचाप में परिवर्तन, अनियमित दिल की धड़कन;
- मांसपेशियों में ऐंठन, ऐंठन, मरोड़;
- पेट में ऐंठनयुक्त दर्द, दस्त के साथ;
- बालों का झड़ना, भंगुर नाखून;
- बार-बार सिरदर्द होना।
अतिरिक्त मैग्नीशियम के लक्षण
- उनींदापन, बिगड़ा हुआ समन्वय, भाषण;
- सुस्ती;
- धीमी हृदय गति;
- मतली, उल्टी, दस्त;
- शुष्क श्लेष्मा झिल्ली (विशेषकर मौखिक गुहा)।
रक्त में मैग्नीशियम का उच्च स्तर (हाइपरमैग्नेसीमिया) कैल्शियम (सीए) की खुराक के बिना, मैग्नीशियम की तैयारी के अत्यधिक सेवन के कारण होता है।
खाद्य पदार्थों में मैग्नीशियम की मात्रा को प्रभावित करने वाले कारक
आधुनिक खाद्य प्रसंस्करण विधियाँ मैग्नीशियम की मात्रा को कम करती हैं। यहां तक कि मैग्नीशियम से भरपूर खाद्य पदार्थों से भी, अगर खाद्य पदार्थों को पानी में भिगोया जाए तो यह नष्ट हो जाता है, लेकिन भोजन के लिए काढ़े और अर्क का उपयोग नहीं किया जाता है।
खनिज तत्व.doc
खनिज पदार्थ1. मानव शरीर में खनिज तत्वों की भूमिका 1
2. मैक्रोन्यूट्रिएंट्स, उनकी विशेषताएं
3. ट्रेस तत्व, उनकी विशेषताएं
4. तकनीकी प्रसंस्करण का प्रभाव
खाद्य उत्पादों की खनिज संरचना पर
5. खनिज पदार्थों के निर्धारण की विधियाँ
1. मानव शरीर में खनिज तत्वों की भूमिका
खनिज लवण, आयन, जटिल यौगिकों और कार्बनिक पदार्थों के रूप में कई तत्व जीवित पदार्थ का हिस्सा हैं और आवश्यक पोषक तत्व हैं जिनका भोजन के साथ प्रतिदिन सेवन किया जाना चाहिए। मुख्य खाद्य पदार्थों में खनिजों की मात्रा तालिका में दी गई है। 5.1.
शरीर में मैग्नीशियम की कमी का निर्धारण कैसे करें?
आवश्यक धातुओं का पहला संकेत लक्षणों का उलटना और मवेशियों में इष्टतम विकास की बहाली है। समय के साथ, जैव रासायनिक अध्ययनों ने उन एंजाइमों को अलग कर दिया जिनके लिए कार्य करने के लिए धातु आयनों की आवश्यकता होती है, और इसके तुरंत बाद, ये विशिष्ट एंजाइम कमी के लक्षणों से जुड़े हो सकते हैं।
पाचन तंत्र में परिवर्तन
धातु आयन अंतःक्रियाओं को प्रणाली के लिए हानिकारक और मूल्यवान माना गया। उदाहरण के लिए, एक प्रारंभिक अध्ययन से पता चला है कि तांबे ने प्रयोगशाला में दूध-आधारित आहार खाने वाले चूहों में एनीमिया को कम करने में लोहे के प्रभाव को बढ़ाया; यह अवलोकन मुर्गियों और सूअरों में दोहराया गया और जल्द ही उन चिकित्सकों का ध्यान आकर्षित किया जिन्होंने एनीमिया से पीड़ित मनुष्यों के इलाज के लिए एक समान द्विधातु प्रोटोकॉल अपनाया। एक ही समय में अर्ध-शुद्ध आहार के आगमन के साथ, पोषण विज्ञान आवश्यक खनिज तत्वों की भूमिका के बारे में महत्वपूर्ण खोजों की दहलीज पर था।
यूएस नेशनल एकेडमी ऑफ साइंसेज के आहार आयोग की सिफारिश के अनुसार, भोजन के साथ रासायनिक तत्वों का दैनिक सेवन एक निश्चित स्तर पर होना चाहिए (तालिका 5.2)। शरीर से प्रतिदिन समान संख्या में रासायनिक तत्वों का उत्सर्जन होना चाहिए, क्योंकि इसमें उनकी सामग्री अपेक्षाकृत स्थिर होती है।
खनिज सहकारकों में अधिकांश धातु आयनों के साथ अकार्बनिक पदार्थों का एक बड़ा समूह होता है। धातु आयन डोमेन में मैक्रोमेटल्स, ट्रेस मेटल आयन और मेटलॉइड्स शामिल हैं। उनकी आवश्यकता के कारण की तलाश में, हमें यह समझना चाहिए कि धातु आयन एंजाइमेटिक सतहों पर खतरनाक रासायनिक प्रतिक्रियाएं करने के लिए उपयुक्त हैं, ऐसी प्रतिक्रियाएं जो एंजाइम में अधिक संवेदनशील कार्बनिक अमीनो एसिड साइड चेन को नुकसान पहुंचा सकती हैं। उदाहरण के लिए, लोहा, मैंगनीज और तांबा जैसी रेडॉक्स धातुएं अपनी संरचना में इलेक्ट्रॉनों को स्वीकार कर सकती हैं, उन्हें अस्थायी रूप से पकड़ सकती हैं, और फिर एक इलेक्ट्रॉन को सुरक्षित रूप से निकालने के तरीके के रूप में पानी बनाने के लिए उन्हें ऑक्सीजन में स्थानांतरित कर सकती हैं।
मानव शरीर में खनिजों की भूमिका बेहद विविध है, इस तथ्य के बावजूद कि वे पोषण का एक अनिवार्य घटक नहीं हैं। खनिज पदार्थ प्रोटोप्लाज्म और जैविक तरल पदार्थों में निहित होते हैं, वे आसमाटिक दबाव की स्थिरता सुनिश्चित करने में एक प्रमुख भूमिका निभाते हैं, जो कोशिकाओं और ऊतकों के सामान्य कामकाज के लिए एक आवश्यक शर्त है। वे जटिल कार्बनिक यौगिकों (उदाहरण के लिए, हीमोग्लोबिन, हार्मोन, एंजाइम) का हिस्सा हैं, हड्डी और दंत ऊतक के निर्माण के लिए एक प्लास्टिक सामग्री हैं। आयनों के रूप में, खनिज पदार्थ तंत्रिका आवेगों के संचरण में शामिल होते हैं, रक्त के थक्के जमने और शरीर की अन्य शारीरिक प्रक्रियाएं प्रदान करते हैं।
संक्षेप में, यह ध्यान में रखा जाना चाहिए कि धातु सहकारक उपलब्ध उत्प्रेरक कार्यों के प्रदर्शन का विस्तार करता है और एंजाइमों द्वारा किया जाता है। वे एंजाइम जो सहकारक के रूप में धातु आयनों पर निर्भर होते हैं, 2 श्रेणियों में आते हैं: धातु सक्रिय एंजाइम और मेटलोएंजाइम। जैसा कि नाम से पता चलता है, धातु-सक्रिय एंजाइम प्रोटीन के बाहर एक मोनो या डाइवैलेंट धातु आयन की उपस्थिति से उच्च उत्प्रेरक गतिविधि के लिए प्रेरित होते हैं। धातु सब्सट्रेट को सक्रिय कर सकती है, एंजाइम को सीधे बांध सकती है, या सब्सट्रेट या बेहतर उत्प्रेरक वातावरण के साथ अधिक अनुकूल बंधन प्राप्त करने के लिए अपने आयनिक चार्ज का उपयोग करके एंजाइम के साथ संतुलन में आ सकती है।
मानव शरीर और खाद्य उत्पादों में खनिजों की मात्रा के आधार पर उन्हें विभाजित किया जाता है मैक्रो- और तत्वों का पता लगाना।इसलिए, यदि शरीर में किसी तत्व का द्रव्यमान अंश 10 -2% से अधिक है, तो इसे एक स्थूल तत्व माना जाना चाहिए। शरीर में ट्रेस तत्वों का अनुपात 10 -3 -10 -5% है। यदि किसी तत्व की सामग्री 10 -5% से कम है, तो इसे अल्ट्रामाइक्रोतत्व माना जाता है। मैक्रोन्यूट्रिएंट्स में पोटेशियम, सोडियम, कैल्शियम, मैग्नीशियम, फॉस्फोरस, क्लोरीन और सल्फर शामिल हैं। वे प्रति 100 ग्राम ऊतक या भोजन में सैकड़ों और दसियों मिलीग्राम में मापी गई मात्रा में निहित होते हैं। ट्रेस तत्व एक मिलीग्राम के दसवें, सौवें और हजारवें हिस्से में व्यक्त सांद्रता में शरीर के ऊतकों का हिस्सा होते हैं और इसके सामान्य कामकाज के लिए आवश्यक होते हैं। ट्रेस तत्वों को सशर्त रूप से दो समूहों में विभाजित किया जाता है: पूर्ण या महत्वपूर्ण (कोबाल्ट, लोहा, तांबा, जस्ता, मैंगनीज, आयोडीन, ब्रोमीन, फ्लोरीन) और तथाकथित संभवतः आवश्यक (एल्यूमीनियम, स्ट्रोंटियम, मोलिब्डेनम, सेलेनियम, निकल, वैनेडियम और कुछ अन्य) ). ट्रेस तत्वों को महत्वपूर्ण कहा जाता है यदि उनकी अनुपस्थिति या कमी से शरीर की सामान्य कार्यप्रणाली बाधित हो जाती है।
शरीर में ट्रेस तत्वों का वितरण उनके रासायनिक गुणों पर निर्भर करता है और बहुत विविध है। उदाहरण के लिए, आयरन, हीमोग्लोबिन, मायोग्लोबिन और अन्य श्वसन वर्णकों का एक अभिन्न अंग है, यानी, शरीर के सभी ऊतकों तक ऑक्सीजन के अवशोषण और परिवहन में शामिल पदार्थ; तांबे के परमाणु कई एंजाइमों आदि के सक्रिय केंद्र में शामिल होते हैं।
इसलिए, धातु-सक्रिय एंजाइमों को धातु की अधिक मात्रा में मौजूद होने की आवश्यकता होती है, शायद एंजाइम की सांद्रता से 2-10 गुना। क्योंकि धातु अधिक स्थायी तरीके से बंध नहीं सकती है, धातु-सक्रिय एंजाइम आमतौर पर शुद्धिकरण के दौरान गतिविधि खो देते हैं।
इसके विपरीत, धातु एंजाइमों में एक धातु सहकारक होता है जो प्रोटीन की सतह पर एक विशिष्ट क्षेत्र से कसकर बंधा होता है। कुछ अपवादों के साथ, ट्रेस धातुएं धातु एंजाइमों के लिए सहकारक के रूप में चित्र में प्रवेश करती हैं। एक मजबूत संघ धातु आयन को डायलिसिस द्वारा खोना या कमजोर विघटनकारी एजेंटों द्वारा खोना असंभव बना देता है। हालाँकि, धातु एंजाइम अपने धातु सहकारक को खो सकते हैं और धातु केलेटर्स के साथ उपचार करने पर निष्क्रिय हो सकते हैं, जिनमें एंजाइम की तुलना में अधिक मजबूत बंधन संबंध होते हैं और धातु आयन द्वारा एंजाइम प्रोटीन पर काबू पा लिया जाता है।
सूक्ष्म तत्वों की क्रिया अप्रत्यक्ष भी हो सकती है - चयापचय की तीव्रता या प्रकृति पर प्रभाव के माध्यम से। तो, कुछ ट्रेस तत्व (उदाहरण के लिए, मैंगनीज, जस्ता, आयोडीन) विकास को प्रभावित करते हैं, और भोजन के साथ उनका अपर्याप्त सेवन बच्चे के सामान्य शारीरिक विकास में बाधा डालता है। अन्य ट्रेस तत्व (उदाहरण के लिए, मोलिब्डेनम, तांबा, मैंगनीज) प्रजनन कार्य में शामिल होते हैं, और शरीर में उनकी कमी मानव जीवन के इस पक्ष को नकारात्मक रूप से प्रभावित करती है।
कृत्रिम समूहों के रूप में, मेटलोएंजाइम में धातुओं का एक स्टोइकोमेट्रिक अनुपात होता है जो एक पूर्ण इंटीग्रेटर द्वारा दर्शाया जाता है। मेटालोएंजाइम अपने संयुग्मित धातु आयन को एंजाइम में जोड़कर गतिविधि बढ़ाने के लिए शायद ही कभी तैयार होते हैं। स्थानिक ज्यामिति भी एक चिंता का विषय है: क्षणिकों की पहली श्रृंखला में धातुओं को धातु बंधन स्थल के आसपास सख्त ज्यामितीय विन्यास का पालन करना चाहिए।
जिंक वाले लोगों को छोड़कर, पहली क्षणिक श्रृंखला की धातुओं वाले एंजाइम बहुत उज्ज्वल होते हैं; उदाहरण के लिए, हीमोग्लोबिन का लाल रंग या तांबे से जुड़ा सेरुलोप्लास्मिन का नीला रंग। अधिकांश एंजाइम लोहे को लोहे के साथ मिलाते हैं, या तो हीम के रूप में या सल्फर समूहों के साथ लोहे की एक विशेष व्यवस्था के रूप में, जिसे लौह-सल्फर केंद्र के रूप में जाना जाता है। हीम में आयरन क्लोरोफिल में मैग्नीशियम आयनों के लिए एक मजबूत संबंध दर्शाता है। हेम, जो मूल रूप से केंद्र में स्थित लोहे के साथ एक पोर्फिरिन रिंग प्रणाली है, जैविक प्रोटीन में लोहे का सबसे प्रचुर रूप है।
आधुनिक मनुष्य के आहार में सबसे अधिक कमी वाले खनिज कैल्शियम और आयरन हैं, और अतिरिक्त खनिज सोडियम और फास्फोरस हैं।
आहार में किसी भी खनिज पदार्थ की कमी या अधिकता प्रोटीन, वसा, कार्बोहाइड्रेट, विटामिन के चयापचय में व्यवधान का कारण बनती है, जिससे कई बीमारियों का विकास होता है। मानव शरीर में विभिन्न रासायनिक तत्वों की कमी के विशिष्ट (विशिष्ट) लक्षण नीचे दिए गए हैं: आहार में कैल्शियम और फास्फोरस की मात्रा में विसंगति का सबसे आम परिणाम दंत क्षय, हड्डियों का पतला होना है। पीने के पानी में फ्लोराइड की कमी से दांतों का इनेमल नष्ट हो जाता है, भोजन और पानी में आयोडीन की कमी से थायरॉइड रोग हो जाते हैं। इस प्रकार, कई बीमारियों के उन्मूलन और रोकथाम के लिए खनिज बहुत महत्वपूर्ण हैं।
सर्वाधिक सामान्य कनेक्शन
लौह-सल्फर केंद्रों के एक घटक के रूप में, लौह एंजाइमों में सिस्टीन अवशेषों के साथ कई समूह योजनाओं में प्रवेश करता है जो प्रोटीन के साथ अधिक सीधे संपर्क की अनुमति देते हैं। इन केंद्रों पर लोहा सब्सट्रेट से बंधता है और साथ ही इलेक्ट्रॉनों को स्थानांतरित करता है और उन प्रतिक्रियाओं में भाग लेता है जिनमें निर्जलीकरण और पुनर्व्यवस्था शामिल है। लौह-सल्फर केंद्रों वाले एंजाइमों में ज़ैंथिन ऑक्सीडेज, सक्सेनेट डिहाइड्रोजनेज, एकोनिटेज़ और नाइट्रिक एसिड शामिल हैं।
यह व्यवस्था एंजाइम को एक बहुत ही स्थिर सी-एच बंधन से हाइड्रोजन परमाणु को हटाने की अनुमति देती है। इन संकुलों में एक अधातु लोहे का स्थान ले सकती है। हीम समूह वाले एंजाइम आमतौर पर लाल भूरे रंग के होते हैं। रंग ने इन प्रोटीनों में प्रारंभिक रुचि को प्रेरित किया और माइटोकॉन्ड्रिया में हीम प्रोटीन को "साइटोक्रोम" के रूप में लेबल करने के लिए एक प्रेरक कारक था।


हम खनिज पदार्थों के चयापचय संबंधी विकारों के कारणों को सूचीबद्ध करते हैं जो भोजन में उनकी पर्याप्त मात्रा के साथ भी हो सकते हैं:
ए) असंतुलित पोषण (प्रोटीन, वसा, कार्बोहाइड्रेट, विटामिन, आदि की अपर्याप्त या अत्यधिक मात्रा);
हालाँकि केवल कुछ घुलनशील एंजाइमों में सहकारक के रूप में लोहा होता है, लेकिन झिल्ली से बंधे प्रोटीन में लोहा विशेष रूप से प्रमुख होता है जिसमें इलेक्ट्रॉन परिवहन मार्ग होते हैं। लोहे का रेडॉक्स गुण सहकारक के रूप में इसके रसायन विज्ञान में एक बड़ी भूमिका निभाता है। आयरन लगभग हमेशा इलेक्ट्रॉन स्थानांतरण में शामिल होता है और अक्सर ऑक्सीजन अणु को इलेक्ट्रॉन दान करता है।
कैटालेज़ और पेरोक्सीडेज़, दो हीम एंजाइम, खतरनाक ऑक्सीडेंट के साथ बातचीत करने के लिए लोहे का उपयोग करते हैं। दोनों एंजाइम साइटोसोल और पेरोक्सीसोम में स्थित होते हैं, जहां सामान्य चयापचय घटनाओं के दौरान हानिकारक ऑक्सीकरण प्रतिक्रियाएं होती हैं। शायद सबसे परिचित लौह युक्त एंजाइम साइटोक्रोम सी ऑक्सीडेज है, जो माइटोकॉन्ड्रियल इलेक्ट्रॉन परिवहन श्रृंखला में टर्मिनल इलेक्ट्रॉन स्वीकर्ता और पानी बनाने के लिए ऑक्सीजन अणु को विभाजित करने में सक्षम एंजाइम है।
बी) खाद्य उत्पादों के पाक प्रसंस्करण के तरीकों का उपयोग, जिससे खनिजों का नुकसान होता है, उदाहरण के लिए, मांस, मछली को डीफ़्रॉस्ट करते समय (गर्म पानी में), या सब्जियों और फलों के काढ़े को हटाते समय, जहां घुलनशील लवण गुजरते हैं;
सी) शारीरिक कारणों से जुड़े खनिजों के लिए शरीर की आवश्यकता में परिवर्तन होने पर आहार की संरचना में समय पर सुधार की कमी। इसलिए, उदाहरण के लिए, उच्च परिवेश के तापमान की स्थिति में काम करने वाले लोगों में, पोटेशियम, सोडियम, क्लोरीन और अन्य खनिजों की आवश्यकता इस तथ्य के कारण बढ़ जाती है कि उनमें से अधिकांश पसीने के साथ शरीर से बाहर निकल जाते हैं;
मानव शरीर में मैग्नीशियम की भूमिका
जिंक शायद सभी धातु सहकारकों में सबसे प्रचुर और बहुमुखी है। 300 से अधिक एंजाइमों में जिंक सहकारक होता है। स्तनधारी जीनोम का लगभग 3% जिंक फिंगर प्रोटीन को एनकोड करता है। सहकारक के रूप में, जस्ता संरचनात्मक और उत्प्रेरक दोनों कार्य कर सकता है। ये उदाहरण बताते हैं कि जिंक एंजाइम और प्रोटीन के लिए एक महत्वपूर्ण साथी क्यों है।
जिंक को एक नरम धातु माना जाता है क्योंकि यह बिना अधिक ज्यामितीय प्राथमिकता के एक द्विसंयोजक धनायन की तरह व्यवहार करता है। शायद यह कोमलता जिंक को कई अलग-अलग किण्वन वातावरणों के अनुकूल होने की अनुमति देती है। इस कारण से, जिंक कॉम्प्लेक्स रंगहीन होते हैं और जिंक स्वयं मुख्य रूप से धनायन के रूप में व्यवहार करता है। एक अन्य उदाहरण एस्टर या एमाइड बांड को ध्रुवीकृत करने के लिए जस्ता का उपयोग है, जिससे यौगिक पर पानी के न्यूक्लियोफिलिक हमले की सुविधा मिलती है, जैसे कि कार्बोक्सीपेप्टिडेज़ और एमिनोपेप्टिडेज़ उत्प्रेरित प्रतिक्रियाओं में।
डी) जठरांत्र संबंधी मार्ग में खनिजों के अवशोषण की प्रक्रिया का उल्लंघन या द्रव हानि में वृद्धि (उदाहरण के लिए, रक्त की हानि)।
^
2. मैक्रोन्यूट्रिएंट्स, उनकी विशेषताएं
कैल्शियम.यह हड्डियों और दांतों का मुख्य संरचनात्मक घटक है; कोशिकाओं, कोशिका और ऊतक तरल पदार्थ के नाभिक का हिस्सा है, रक्त के थक्के जमने के लिए आवश्यक है। कैल्शियम प्रोटीन, फॉस्फोलिपिड, कार्बनिक अम्ल के साथ यौगिक बनाता है; कोशिका झिल्ली की पारगम्यता के नियमन में, तंत्रिका आवेगों के संचरण में, मांसपेशियों के संकुचन के आणविक तंत्र में भाग लेता है, कई एंजाइमों की गतिविधि को नियंत्रित करता है। तो कैल्शियमयह न केवल प्लास्टिक कार्य करता है, बल्कि शरीर में कई जैव रासायनिक और शारीरिक प्रक्रियाओं को भी प्रभावित करता है।
तांबा, लोहे की तरह, एक रेडॉक्स धातु है। कॉपर एंजाइम, हालांकि जिंक एंजाइम जितने असंख्य नहीं हैं, मुख्य रूप से साइटोसोल में महत्वपूर्ण जैविक कार्य करते हैं। सबसे जटिल एंजाइमों में मल्टीकोरेक्स ऑक्सीडेज शामिल हैं, जिनमें प्रति एंजाइम कम से कम 4 या अधिक से अधिक 8 कॉपर परमाणु हो सकते हैं। इन एंजाइमों में तांबा तीन अलग-अलग रासायनिक वातावरणों में मौजूद होता है, जिन्हें टाइप 1, टाइप 2 और टाइप कॉपर पैच के रूप में जाना जाता है। कॉपर टाइप 1 साइट तांबे के साथ सेरुलोप्लास्मिन और अन्य नीले प्रोटीन को नीला रंग देती है।
पॉलीऑक्साइड ऑक्सीडेज में कॉपर बाइंडिंग साइटें एक समद्विबाहु त्रिभुज में व्यवस्थित प्रकार 3 कॉपर 2 और 3 कॉपर से मिलकर एक त्रिक बनाती हैं। ऑक्सीजन त्रिभुज के आधार पर इन दो प्रकार के 3 मेडिक्स से जुड़ती है। इलेक्ट्रॉनों को स्वीकार करने की अपनी प्रवृत्ति के कारण, तांबा जैविक प्रणालियों में एक शक्तिशाली ऑक्सीकरण एजेंट है। यह प्रतिक्रिया लोहे के चयापचय को तांबे से जोड़ती है और यह बता सकती है कि लोहे में तांबे की कमी कैसे लोहे के स्थानांतरण को रोकती है और मनुष्यों में एनीमिया का कारण बनती है। शायद ही कभी तांबे को केवल एक संरचनात्मक भूमिका निभाने के लिए कहा जाता है, और कई एंजाइम जिनमें तांबा एक सहकारक के रूप में होता है, सक्रिय स्थल पर धातु का उपयोग करते हैं।
कैल्शियम एक पचने में कठिन तत्व है। भोजन के साथ मानव शरीर में प्रवेश करने वाले कैल्शियम यौगिक पानी में व्यावहारिक रूप से अघुलनशील होते हैं। छोटी आंत का क्षारीय वातावरण अपचनीय कैल्शियम यौगिकों के निर्माण को बढ़ावा देता है, और केवल पित्त एसिड की क्रिया ही इसके अवशोषण को सुनिश्चित करती है।
ऊतकों द्वारा कैल्शियम का अवशोषण न केवल खाद्य पदार्थों में इसकी सामग्री पर निर्भर करता है, बल्कि अन्य खाद्य घटकों और सबसे पहले, वसा, मैग्नीशियम, फास्फोरस और प्रोटीन के साथ इसके अनुपात पर भी निर्भर करता है। वसा की अधिकता के साथ, पित्त एसिड के लिए प्रतिस्पर्धा होती है और कैल्शियम का एक महत्वपूर्ण हिस्सा बड़ी आंत के माध्यम से शरीर से उत्सर्जित होता है। मैग्नीशियम की अधिकता से कैल्शियम का अवशोषण प्रतिकूल रूप से प्रभावित होता है; इन तत्वों का अनुशंसित अनुपात 1:0.5 है। यदि फास्फोरस की मात्रा भोजन में कैल्शियम के स्तर से 2 गुना से अधिक हो जाती है, तो घुलनशील लवण बनते हैं, जो हड्डी के ऊतकों से रक्त द्वारा निकाले जाते हैं। कैल्शियम रक्त वाहिकाओं की दीवारों में प्रवेश करता है, जो उनकी नाजुकता का कारण बनता है, साथ ही गुर्दे के ऊतकों में भी प्रवेश करता है, जो गुर्दे की पथरी की घटना में योगदान कर सकता है। वयस्कों के लिए, भोजन में कैल्शियम और फास्फोरस का अनुशंसित अनुपात 1:1.5 है। इस अनुपात को बनाए रखने में कठिनाई इस तथ्य के कारण है कि आमतौर पर खाए जाने वाले अधिकांश खाद्य पदार्थों में कैल्शियम की तुलना में फास्फोरस अधिक मात्रा में होता है। कई पादप उत्पादों में मौजूद फाइटिन और ऑक्सालिक एसिड कैल्शियम के अवशोषण पर नकारात्मक प्रभाव डालते हैं। ये यौगिक कैल्शियम के साथ अघुलनशील लवण बनाते हैं।
अनुसंधान ने तांबे के आयनों को धमनी निर्माण या एंजियोजेनेसिस से जोड़ा है। सबसे रोमांचक खोजों में से एक, जिसे अभी तक पूरी तरह से समझा नहीं जा सका है, वह यह है कि किसी जानवर को तांबे से वंचित करने से कैंसर के ट्यूमर के विकास में देरी होती है या यहां तक कि यह रुक भी जाता है। पोषण की दृष्टि से, इसका मतलब यह हो सकता है कि तांबा माइक्रोवैस्कुलर विकास के लिए आवश्यक है।
क्या आप जानते हैं कि
जबकि जिंक एंजाइमों में सबसे आम संक्रमण धातु हो सकता है, मैंगनीज शायद सबसे कम आम है, क्योंकि प्रोटीन के साथ मैंगनीज कॉम्प्लेक्स कमजोर रूप से स्थिर होते हैं और आसानी से अलग हो जाते हैं। ज्ञात मैंगनीज मेटालोएंजाइम में माइटोकॉन्ड्रिया में पाइरूवेट कार्बोक्सिलेज और मैंगनीज सुपरऑक्साइड डिसम्यूटेज और यूरिया चक्र में आर्गिनेज शामिल हैं। मैंगनीज कई एंजाइमों के लिए धातु-सक्रिय सहकारक के रूप में भी कार्य कर सकता है जिनके लिए मैग्नीशियम की आवश्यकता होती है।
एक वयस्क में कैल्शियम की दैनिक आवश्यकता 800 मिलीग्राम है, और बच्चों और किशोरों में - 1000 मिलीग्राम या अधिक।
कैल्शियम के अपर्याप्त सेवन या शरीर में इसके अवशोषण के उल्लंघन (विटामिन डी की कमी के साथ) के साथ, कैल्शियम की कमी की स्थिति विकसित होती है। हड्डियों और दांतों से इसका उत्सर्जन बढ़ जाता है। वयस्कों में, ऑस्टियोपोरोसिस विकसित होता है - हड्डी के ऊतकों का विखनिजीकरण, बच्चों में, कंकाल का गठन परेशान होता है, रिकेट्स विकसित होता है।
मैग्नीशियम की कमी के साथ पोषण की विशेषताएं
यद्यपि मैंगनीज को उसकी प्रतिक्रियाशीलता के आधार पर रेडॉक्स धातु नहीं माना जाता है, फिर भी यह 6 ऑक्सीकरण अवस्थाओं में मौजूद हो सकता है, जिनमें से तीन जैविक प्रणालियों में नहीं देखी जाती हैं। कोबाल्ट गे के समान एक रिंग में एक चौकोर, सपाट व्यवस्था में जुड़ा हुआ है, लेकिन बहुत विशेष विशेषताओं के साथ। हीम के विपरीत, कोबाल्ट में 2 अक्षीय लिगेंड होते हैं जो प्रोटीन से मुक्त होते हैं, जो प्रोटीन समूहों को विमान के ऊपर और नीचे केंद्रीय धातु तक पहुंचने की अनुमति देते हैं।
कैल्शियम का सबसे अच्छा स्रोत दूध और डेयरी उत्पाद, विभिन्न चीज और पनीर (100-1000 मिलीग्राम / 100 ग्राम उत्पाद), हरा प्याज, अजमोद, बीन्स हैं। अंडे, मांस, मछली, सब्जियां, फल, जामुन (20-40 मिलीग्राम / 100 ग्राम उत्पाद) में काफी कम कैल्शियम पाया जाता है।
मैग्नीशियम.यह तत्व कई प्रमुख एंजाइमों की गतिविधि के लिए आवश्यक है। शरीर के चयापचय के लिए. मैग्नीशियम तंत्रिका तंत्र और हृदय की मांसपेशियों के सामान्य कार्य को बनाए रखने में शामिल है; एक वासोडिलेटिंग प्रभाव है; पित्त स्राव को उत्तेजित करता है; आंत की मोटर गतिविधि को बढ़ाता है, जो शरीर से विषाक्त पदार्थों (कोलेस्ट्रॉल सहित) को निकालने में मदद करता है।
गर्भवती महिलाओं के लिए मैग्नीशियम की कमी खतरनाक क्यों है?
एक अष्टफलकीय परिसर में, एक अक्षीय स्थिति पर आमतौर पर एक बेंज़िमिडाज़ोल और दूसरे पर मिथाइल समूह का कब्ज़ा होता है। यह उपकरण अद्वितीय है और कोबाल्ट को दो अलग-अलग प्रतिक्रियाओं की क्षमता के साथ कार्बन-धातु बंधन बनाने की अनुमति देता है। उदाहरण के लिए, कोबाल्ट में दोनों इलेक्ट्रॉनों को पकड़कर मिथाइल समूह को कार्बोनियम आयन के रूप में हटाया जा सकता है, जो फिर कम स्थिर में बदल जाता है।
स्थितीय क्रमपरिवर्तन में, कोबाल्ट केवल एक इलेक्ट्रॉन को बरकरार रखता है और एक मुक्त कण की रिहाई के साथ एक स्थिर सह-आयन 7 बनाता है। मुक्त कण अत्यधिक प्रतिक्रियाशील होते हैं और अन्य अभिकारकों द्वारा धारण की जा सकने वाली ऊर्जा बाधाओं को दूर कर देते हैं। इस प्रकार, कोबाल्ट स्थानांतरण समूहों के रासायनिक गुण, जैसे कार्बोनियम आयन, या अत्यधिक प्रतिक्रियाशील कार्बन-केंद्रित रेडिकल। दोनों उत्पाद संभव हैं और मुक्त कण तंत्र के माध्यम से प्रतिक्रिया को आगे बढ़ाने के लिए सहकारक के रूप में कोबाल्ट की आवश्यकता की व्याख्या करते हैं।
भोजन में फाइटिन और अतिरिक्त वसा और कैल्शियम की उपस्थिति से मैग्नीशियम का अवशोषण बाधित होता है। मैग्नीशियम की दैनिक आवश्यकता सटीक रूप से परिभाषित नहीं है; हालाँकि, यह माना जाता है कि 200-300 मिलीग्राम / दिन की खुराक कमी की अभिव्यक्ति को रोकती है (यह माना जाता है कि लगभग 30% मैग्नीशियम अवशोषित होता है)।
मैग्नीशियम की कमी से, भोजन का अवशोषण बाधित हो जाता है, विकास में देरी होती है, रक्त वाहिकाओं की दीवारों में कैल्शियम जमा हो जाता है और कई अन्य रोग संबंधी घटनाएं विकसित होती हैं। मनुष्यों में, पोषण की प्रकृति के कारण, मैग्नीशियम आयनों की कमी की संभावना बेहद कम है। हालाँकि, दस्त के साथ इस तत्व की बड़ी हानि हो सकती है; यदि ऐसे तरल पदार्थ जिनमें मैग्नीशियम नहीं होता है, उन्हें शरीर में प्रवेश कराया जाता है तो उनके परिणाम महसूस होते हैं। जब सीरम मैग्नीशियम सांद्रता लगभग 0.1 mmol / l तक गिर जाती है, तो डिलिरियम ट्रेमेंस जैसा एक सिंड्रोम हो सकता है: एक व्यक्ति में अर्ध-कोमा की स्थिति होती है, मांसपेशियों में कंपन, कलाई और पैर में मांसपेशियों में ऐंठन, ध्वनि के जवाब में न्यूरोमस्कुलर उत्तेजना में वृद्धि, यांत्रिक और दृश्य उत्तेजनाएँ। मैग्नीशियम की शुरूआत से स्थिति में तेजी से सुधार होता है।
मैग्नीशियम मुख्य रूप से पादप खाद्य पदार्थों में समृद्ध होता है। इसमें बड़ी मात्रा में गेहूं की भूसी, विभिन्न अनाज (40 - 200 मिलीग्राम / 100 ग्राम उत्पाद), फलियां, खुबानी, सूखे खुबानी, आलूबुखारा शामिल हैं। डेयरी उत्पादों, मांस, मछली, पास्ता, अधिकांश सब्जियों और फलों (20 - 40 मिलीग्राम / 100 ग्राम) में थोड़ा मैग्नीशियम होता है।
पोटैशियम. लगभग 90% पोटैशियम कोशिकाओं के अंदर होता है। यह अन्य लवणों के साथ मिलकर आसमाटिक दबाव प्रदान करता है; तंत्रिका आवेगों के संचरण में भाग लेता है; जल-नमक चयापचय का विनियमन; पानी को हटाने को बढ़ावा देता है, और, परिणामस्वरूप, शरीर से विषाक्त पदार्थों को; शरीर के आंतरिक वातावरण के एसिड-बेस संतुलन को बनाए रखता है;हृदय और अन्य अंगों की गतिविधि के नियमन में भाग लेता है; कई एंजाइमों के कामकाज के लिए आवश्यक है।
पोटेशियम आंतों से अच्छी तरह से अवशोषित होता है, और इसकी अतिरिक्त मात्रा मूत्र के साथ शरीर से जल्दी निकल जाती है। एक वयस्क में पोटेशियम की दैनिक आवश्यकता 2000-4000 मिलीग्राम है। यह अधिक पसीना आने से, मूत्रवर्धक के प्रयोग से, हृदय और यकृत के रोगों में बढ़ जाता है। आहार में पोटेशियम की कमी नहीं होती है और विविध आहार से पोटेशियम की कमी नहीं होती है। शरीर में पोटेशियम की कमी तब प्रकट होती है जब न्यूरोमस्कुलर और कार्डियोवास्कुलर सिस्टम का कार्य ख़राब हो जाता है, उनींदापन, रक्तचाप कम हो जाता है और हृदय संबंधी अतालता होती है। ऐसे मामलों में, पोटेशियम आहार निर्धारित किया जाता है।
अधिकांश पोटैशियम पादप खाद्य पदार्थों से आता है। इसके समृद्ध स्रोत खुबानी, आलूबुखारा, किशमिश, पालक, समुद्री शैवाल, सेम, मटर, आलू, अन्य सब्जियां और फल (100 - 600 मिलीग्राम / 100 ग्राम उत्पाद) हैं। खट्टा क्रीम, चावल, प्रीमियम आटे से बनी ब्रेड (100 - 200 मिलीग्राम / 100 ग्राम) में कम पोटेशियम पाया जाता है।
सोडियम.सोडियम सभी ऊतकों और शरीर के तरल पदार्थों में पाया जाता है। वह ऊतक द्रव और रक्त में आसमाटिक दबाव बनाए रखने में शामिल है; तंत्रिका आवेगों के संचरण में; अम्ल-क्षार संतुलन, जल-नमक चयापचय का विनियमन; पाचन एंजाइमों की गतिविधि को बढ़ाता है।
इसके शारीरिक गुणों और शरीर के लिए महत्व के कारण सोडियम चयापचय का व्यापक अध्ययन किया गया है। यह पोषक तत्व आंतों से आसानी से अवशोषित हो जाता है। सोडियम आयन ऊतक कोलाइड्स की सूजन का कारण बनते हैं, जो शरीर में जल प्रतिधारण का कारण बनता है और इसकी रिहाई को रोकता है। इस प्रकार बाह्य कोशिकीय द्रव में सोडियम की कुल मात्रा इन तरल पदार्थों की मात्रा निर्धारित करती है। प्लाज्मा सोडियम सांद्रता में वृद्धि से प्यास की अनुभूति होती है। गर्म जलवायु में और कठिन शारीरिक श्रम के दौरान, पसीने के साथ सोडियम की काफी कमी हो जाती है और इस खोई हुई मात्रा की भरपाई के लिए शरीर में नमक डालना आवश्यक होता है।
मूल रूप से, सोडियम आयन टेबल नमक - NaCl की कीमत पर शरीर में प्रवेश करते हैं। सोडियम क्लोराइड के अत्यधिक सेवन से गुर्दे, त्वचा और अन्य उत्सर्जन अंगों के माध्यम से चयापचय के पानी में घुलनशील अंतिम उत्पादों का निष्कासन बिगड़ जाता है। शरीर में जल प्रतिधारण हृदय प्रणाली की गतिविधि को जटिल बनाता है, रक्तचाप बढ़ाता है. इसलिए संबंधित बीमारियों में आहार में नमक का सेवन सीमित है। हालाँकि, जब गर्म दुकानों या गर्म जलवायु में काम करते हैं, तो पसीने के साथ होने वाले नुकसान की भरपाई करने और पसीने को कम करने के लिए बाहर से लाए गए सोडियम (साधारण नमक के रूप में) की मात्रा बढ़ा दी जाती है, जो हृदय के कार्य पर बोझ डालता है।
सोडियम सभी खाद्य पदार्थों में प्राकृतिक रूप से मौजूद होता है। खाद्य उत्पादों को प्राप्त करने की विधि काफी हद तक उसमें सोडियम की अंतिम सामग्री निर्धारित करती है। उदाहरण के लिए, जमे हुए हरे मटर में ताजे मटर की तुलना में बहुत अधिक सोडियम होता है। ताजी सब्जियों और फलों में अनाज और पनीर के विपरीत 10 मिलीग्राम/किग्रा से 1 ग्राम/किग्रा से कम सोडियम होता है, जिसमें 10-20 ग्राम/किग्रा की मात्रा में सोडियम हो सकता है।
भोजन से सोडियम की औसत दैनिक खपत का अनुमान लगाना कठिन है क्योंकि भोजन में सोडियम की सांद्रता व्यापक रूप से भिन्न होती है और इसके अलावा, लोगों को भोजन में नमक मिलाने की आदत होती है। एक वयस्क प्रतिदिन 15 ग्राम तक टेबल नमक खाता है और उतनी ही मात्रा शरीर से बाहर निकालता है। यह मात्रा शारीरिक रूप से आवश्यक से कहीं अधिक है और यह मुख्य रूप से सोडियम क्लोराइड के स्वाद, नमकीन खाद्य पदार्थों की आदत से निर्धारित होता है। मानव भोजन में टेबल नमक की मात्रा को स्वास्थ्य को नुकसान पहुंचाए बिना प्रति दिन 5 ग्राम तक कम किया जा सकता है। शरीर से सोडियम क्लोराइड की रिहाई, और, परिणामस्वरूप, इसकी आवश्यकता, शरीर द्वारा प्राप्त पोटेशियम लवण की मात्रा से प्रभावित होती है। पौधों के खाद्य पदार्थ, विशेष रूप से आलू, पोटेशियम से भरपूर होते हैं और मूत्र में सोडियम क्लोराइड के उत्सर्जन को बढ़ाते हैं, और परिणामस्वरूप, इसकी आवश्यकता बढ़ जाती है।
फास्फोरस.फास्फोरस शरीर के सभी ऊतकों, विशेषकर मांसपेशियों और मस्तिष्क में पाया जाता है। यह तत्व शरीर की सभी जीवन प्रक्रियाओं में शामिल होता है। : कोशिकाओं में पदार्थों का संश्लेषण और टूटना; चयापचय का विनियमन; न्यूक्लिक एसिड और कई एंजाइमों का एक हिस्सा है; एटीपी के निर्माण के लिए आवश्यक है।
फॉस्फोरस शरीर के ऊतकों और खाद्य उत्पादों में फॉस्फोरिक एसिड और इसके कार्बनिक यौगिकों (फॉस्फेट) के रूप में पाया जाता है। इसका मुख्य द्रव्यमान कैल्शियम फॉस्फेट के रूप में हड्डी के ऊतकों में होता है, शेष फॉस्फोरस नरम ऊतकों और तरल पदार्थों का हिस्सा होता है। मांसपेशियों में फास्फोरस यौगिकों का सबसे गहन आदान-प्रदान होता है। फॉस्फोरिक एसिड कई एंजाइमों, न्यूक्लिक एसिड आदि के अणुओं के निर्माण में शामिल होता है।
आहार में फास्फोरस की लंबे समय तक कमी के साथ, शरीर हड्डी के ऊतकों से अपने स्वयं के फास्फोरस का उपयोग करता है। इससे हड्डियों का विखनिजीकरण और उनकी संरचना का उल्लंघन होता है - रेयरफैक्शन। जब शरीर में फास्फोरस की कमी हो जाती है, तो मानसिक और शारीरिक प्रदर्शन कम हो जाता है, भूख में कमी, उदासीनता देखी जाती है।
वयस्कों के लिए फास्फोरस की दैनिक आवश्यकता 1200 मिलीग्राम है। यह अत्यधिक शारीरिक या मानसिक तनाव, कुछ बीमारियों के साथ बढ़ता है।
फास्फोरस की एक बड़ी मात्रा पशु उत्पादों में पाई जाती है, विशेष रूप से यकृत, कैवियार, साथ ही अनाज और फलियां में। इन उत्पादों में इसकी सामग्री प्रति 100 ग्राम उत्पाद में 100 से 500 मिलीग्राम तक होती है। अनाज (दलिया, मोती जौ) फॉस्फोरस का एक समृद्ध स्रोत हैं, इनमें 300-350 मिलीग्राम फॉस्फोरस / 100 ग्राम होता है। हालांकि, फॉस्फोरस यौगिक पौधों के उत्पादों से पशु मूल के भोजन खाने से भी बदतर अवशोषित होते हैं।
सल्फर.पोषण में इस तत्व का महत्व सबसे पहले इस तथ्य से निर्धारित होता है कि यह सल्फर युक्त अमीनो एसिड के रूप में प्रोटीन का हिस्सा है। (मेथिओनिन और सिस्टीन), और यह कुछ हार्मोन और विटामिन का भी अभिन्न अंग है।
सल्फर युक्त अमीनो एसिड के एक घटक के रूप में, सल्फर प्रोटीन चयापचय की प्रक्रियाओं में शामिल होता है, और गर्भावस्था और शरीर के विकास के दौरान, परिणामी ऊतकों में प्रोटीन के सक्रिय समावेश के साथ-साथ सूजन के दौरान इसकी आवश्यकता तेजी से बढ़ जाती है। प्रक्रियाएँ।सल्फर युक्त अमीनो एसिड, विशेष रूप से विटामिन सी और ई के संयोजन में, एक स्पष्ट एंटीऑक्सीडेंट प्रभाव होता है। जिंक और सिलिकॉन के साथ, सल्फर बालों और त्वचा की कार्यात्मक स्थिति निर्धारित करता है।
क्लोरीन.यह तत्व गैस्ट्रिक जूस के निर्माण, प्लाज्मा के निर्माण में शामिल होता है, कई एंजाइमों को सक्रिय करता है। यह पोषक तत्व आंतों से रक्त में आसानी से अवशोषित हो जाता है। क्लोरीन की त्वचा में जमा होने, अत्यधिक सेवन से शरीर में बने रहने और महत्वपूर्ण मात्रा में पसीने के साथ बाहर निकलने की क्षमता दिलचस्प है। शरीर से क्लोरीन का उत्सर्जन मुख्य रूप से मूत्र (90%) और पसीने के साथ होता है।
क्लोरीन के आदान-प्रदान में उल्लंघन से एडिमा का विकास, गैस्ट्रिक जूस का अपर्याप्त स्राव आदि होता है। शरीर में क्लोरीन की मात्रा में तेज कमी से गंभीर स्थिति हो सकती है, यहां तक कि मृत्यु भी हो सकती है। रक्त में इसकी सांद्रता में वृद्धि तब होती है जब शरीर निर्जलित होता है, साथ ही गुर्दे के उत्सर्जन कार्य में व्यवधान होता है।
क्लोरीन की दैनिक आवश्यकता लगभग 5000 मिलीग्राम है। भोजन में मिलाने पर क्लोरीन मुख्य रूप से सोडियम क्लोराइड के रूप में मानव शरीर में प्रवेश करता है।
^
3. ट्रेस तत्व, उनकी विशेषताएं
लोहा।यह तत्व उन यौगिकों के जैवसंश्लेषण के लिए आवश्यक है जो श्वसन, हेमटोपोइजिस प्रदान करते हैं; यह इम्यूनोबायोलॉजिकल और रेडॉक्स प्रतिक्रियाओं में भाग लेता है; साइटोप्लाज्म, कोशिका नाभिक और कई एंजाइमों का हिस्सा है।
ऑक्सालिक एसिड और फाइटिन द्वारा आयरन के अवशोषण को रोका जाता है। इस पोषक तत्व को आत्मसात करने के लिए विटामिन बी 12 की आवश्यकता होती है। एस्कॉर्बिक एसिड भी लोहे के अवशोषण में योगदान देता है, क्योंकि लोहे को एक द्विसंयोजक आयन के रूप में अवशोषित किया जाता है।
^ शरीर में आयरन की कमी से एनीमिया, गैस विनिमय, सेलुलर श्वसन का विकास हो सकता है, यानी जीवन सुनिश्चित करने वाली मूलभूत प्रक्रियाएं बाधित हो जाती हैं। आयरन की कमी की स्थिति के विकास में योगदान होता है: शरीर में आत्मसात रूप में आयरन का अपर्याप्त सेवन, पेट की स्रावी गतिविधि में कमी, विटामिन की कमी (विशेषकर बी) 12 , फोलिक और एस्कॉर्बिक एसिड) और कई बीमारियाँ जो खून की कमी का कारण बनती हैं।
एक वयस्क की आयरन की आवश्यकता (14 मिलीग्राम/दिन) सामान्य आहार से अधिक मात्रा में पूरी होती है। हालाँकि, जब भोजन में कम आयरन युक्त मैदे की रोटी का उपयोग किया जाता है, तो शहरी निवासियों में अक्सर आयरन की कमी देखी जाती है। इसी समय, यह ध्यान में रखा जाना चाहिए कि फॉस्फेट और फाइटिन से भरपूर अनाज उत्पाद लोहे के साथ घुलनशील यौगिक बनाते हैं और शरीर द्वारा इसके अवशोषण को कम करते हैं।
लोहा एक व्यापक तत्व है। यह ऑफल, मांस, अंडे, सेम, सब्जियां, जामुन में पाया जाता है। हालाँकि, आसानी से पचने योग्य रूप में, आयरन केवल मांस उत्पादों, लीवर (2000 मिलीग्राम / 100 ग्राम उत्पाद तक), अंडे की जर्दी में पाया जाता है।
ताँबा. तांबा मानव चयापचय में एक आवश्यक तत्व है, जो लाल रक्त कोशिकाओं के निर्माण, ऊतक लौह की रिहाई और कंकाल, केंद्रीय तंत्रिका तंत्र और संयोजी ऊतक के विकास में भूमिका निभाता है।
चूँकि खाद्य पदार्थों में तांबा व्यापक रूप से वितरित होता है, इसलिए यह संभावना नहीं है कि शिशुओं को छोड़कर, विशुद्ध रूप से डेयरी आहार लेने वाले लोगों में कभी भी तांबे से संबंधित कुपोषण विकसित होगा।
किसी व्यक्ति द्वारा तांबे की अत्यधिक बड़ी खुराक के सेवन से श्लेष्म झिल्ली में जलन और क्षरण होता है, केशिकाओं को व्यापक क्षति होती है, यकृत और गुर्दे को नुकसान होता है और केंद्रीय तंत्रिका तंत्र में जलन होती है।इस तत्व की दैनिक आवश्यकता लगभग 2 मिलीग्राम है। तांबे के स्रोत लीवर, अंडे की जर्दी, हरी सब्जियां जैसे खाद्य पदार्थ हैं।
आयोडीन.आयोडीन थायरोक्सिन हार्मोन के निर्माण में शामिल एक आवश्यक तत्व है। आयोडीन की कमी के साथ, गण्डमाला विकसित होती है - थायरॉयड ग्रंथि की एक बीमारी।
आयोडीन की आवश्यकता प्रतिदिन 100-150 एमसीजी तक होती है। खाद्य पदार्थों में आयोडीन की मात्रा आमतौर पर कम (4-15 माइक्रोग्राम%) होती है। समुद्री खाद्य पदार्थ आयोडीन से भरपूर होते हैं। तो, समुद्री मछली में लगभग 50 एमसीजी/100 ग्राम, कॉड लिवर में 800 तक, समुद्री शैवाल में, संग्रह के प्रकार और समय के आधार पर, उत्पाद के 50 एमसीजी से 70,000 एमसीजी/100 ग्राम तक होता है। लेकिन यह ध्यान में रखना चाहिए कि भोजन के दीर्घकालिक भंडारण और गर्मी उपचार के दौरान, आयोडीन का एक महत्वपूर्ण हिस्सा (20 से 60% तक) नष्ट हो जाता है।
स्थलीय पौधों और पशु उत्पादों में आयोडीन की मात्रा मिट्टी में इसकी मात्रा पर अत्यधिक निर्भर है। जिन क्षेत्रों की मिट्टी में आयोडीन कम है, वहां खाद्य उत्पादों में इसकी मात्रा औसत से 10 से 100 गुना कम हो सकती है। अत: इन क्षेत्रों मेंगण्डमाला को रोकने के लिए, टेबल नमक में थोड़ी मात्रा में पोटेशियम आयोडेट (25 मिलीग्राम प्रति 1 किलो नमक) मिलाया जाता है। ऐसे आयोडीन युक्त नमक की शेल्फ लाइफ 6 महीने से अधिक नहीं होती है, क्योंकि नमक के भंडारण के दौरान आयोडीन धीरे-धीरे गायब हो जाता है।
फ्लोरीन.इस तत्व की कमी से दंत क्षय विकसित होता है (दांत इनेमल का विनाश)। फ्लोरीन की अधिकता का भी शरीर पर नकारात्मक प्रभाव पड़ता है, क्योंकि फ्लोरीन लवण हड्डियों में जमा होकर दांतों के रंग और आकार में बदलाव, ओस्टियोचोन्ड्रोसिस, का कारण बनता है। और इसके बाद जोड़ों का मोटा होना और उनकी गतिहीनता, हड्डियों का विकास होता है। फ्लोरीन की उपयोगी और हानिकारक खुराक के बीच का अंतर इतना कम है कि कई शोधकर्ता पानी के फ्लोराइडेशन का विरोध करते हैं।
पानी के साथ सेवन किया गया फ्लोरीन लगभग पूरी तरह से अवशोषित हो जाता है; भोजन में मौजूद फ्लोरीन कुछ हद तक अवशोषित हो जाता है। अवशोषित फ्लोरीन पूरे शरीर में समान रूप से वितरित होता है। यह मुख्य रूप से कंकाल में जमा होता है, और थोड़ी मात्रा दंत ऊतक में जमा होती है। उच्च खुराक में, फ्लोरीन कार्बोहाइड्रेट, लिपिड, प्रोटीन चयापचय, साथ ही विटामिन, एंजाइम और खनिज लवण के चयापचय का उल्लंघन कर सकता है।
विभिन्न देशों में भोजन से फ्लोराइड के दैनिक सेवन का अनुमान लगाया गया है; वयस्कों के लिए, यह मान 0.2 से 3.1 मिलीग्राम तक भिन्न होता है; 1 से 3 वर्ष की आयु वर्ग के बच्चों के लिए, फ्लोराइड का सेवन 0.5 मिलीग्राम/दिन अनुमानित किया गया था।
लगभग सभी खाद्य उत्पादों में इस तत्व की कम से कम मात्रा होती है। सभी प्रकार की वनस्पतियों में कुछ मात्रा में फ्लोरीन होता है, जो वे मिट्टी और पानी से प्राप्त करते हैं। कुछ खाद्य पदार्थों, विशेषकर मछली, कुछ सब्जियों और चाय में फ्लोराइड का उच्च स्तर पाया गया है। खाद्य प्रसंस्करण संयंत्रों में फ्लोराइड युक्त पानी का उपयोग अक्सर तैयार उत्पादों में फ्लोराइड के स्तर को दोगुना कर सकता है।
दंत क्षय की रोकथाम और उपचार के लिए विभिन्न टूथपेस्ट, पाउडर, अमृत, च्युइंग गम आदि का उपयोग किया जाता है, जिनमें मुख्य रूप से अकार्बनिक रूप में फ्लोरीन मिलाया जाता है। इन यौगिकों को आम तौर पर लगभग 1 ग्राम/किग्रा की सांद्रता पर, डेंटिफ़्रिस में शामिल किया जाता है।
क्रोमियम. यह तत्व ग्लूकोज और लिपिड चयापचय और कुछ प्रणालियों द्वारा अमीनो एसिड के उपयोग के लिए आवश्यक प्रतीत होता है। यह मनुष्यों में मधुमेह और एथेरोस्क्लेरोसिस के हल्के रूपों की रोकथाम के लिए भी महत्वपूर्ण है।
क्रोमियम जठरांत्र पथ और श्वसन पथ दोनों से अवशोषित होता है। इनमें से प्रत्येक प्रणाली के लिए अवशोषित मात्रा समान नहीं है और क्रोमियम के रूप पर निर्भर करती है। त्रिसंयोजक क्रोमियम मानव के लिए तत्व का आवश्यक रूप है, हेक्सावेलेंट क्रोमियम विषैला होता है। क्रोमियम मानव शरीर के ऊतकों में असमान, लेकिन आमतौर पर कम सांद्रता में वितरित होता है। फेफड़ों को छोड़कर सभी ऊतकों में क्रोमियम का स्तर उम्र के साथ कम होता जाता है। मनुष्यों में क्रोमियम की सबसे बड़ी मात्रा त्वचा, मांसपेशियों और वसा ऊतक में जमा होती है। यकृत और आंतों में परिवहन के तंत्र सहित होमोस्टैटिक तंत्र, त्रिसंयोजक क्रोमियम के अत्यधिक संचय को रोकते हैं। क्रोमियम शरीर से धीरे-धीरे उत्सर्जित होता है, मुख्यतः मूत्र में।
आज प्रतिदिन लगभग 150 मिलीग्राम क्रोमियम की खपत को आदर्श माना जाता है। यह वृद्ध लोगों के लिए विशेष रूप से उपयोगी है जिनका शरीर कार्बोहाइड्रेट को अच्छी तरह से अवशोषित नहीं करता है, और क्रोमियम इन विशेष यौगिकों की चयापचय प्रक्रियाओं को बढ़ाता है। अकार्बनिक क्रोमियम खराब रूप से अवशोषित होता है, बहुत आसानी से - कार्बनिक यौगिकों में, अर्थात, जिस रूप में यह जीवित जीवों में पाया जाता है।
खाद्य उत्पादों में क्रोमियम का स्तर काफी भिन्न होता है, जो 20 से 550 माइक्रोग्राम प्रति किलोग्राम तक होता है। क्रोमियम के समृद्ध स्रोत ब्रूअर यीस्ट, लीवर (10-80 एमसीजी/100 ग्राम) हैं। कम मात्रा में यह तत्व छिलके वाले आलू, बीफ, ताजी सब्जियां, साबुत आटे की ब्रेड, पनीर में पाया जाता है।
मैंगनीज.मैंगनीज कई एंजाइम प्रणालियों में सहकारक के रूप में आवश्यक है; यह फ्लेवोप्रोटीन के समुचित कार्य में, सल्फेटेड म्यूकोपॉलीसेकेराइड, कोलेस्ट्रॉल, हीमोग्लोबिन के संश्लेषण और कई अन्य चयापचय प्रक्रियाओं में भूमिका निभाता है।. ग्रहण किये गये मैंगनीज में से केवल 3% ही अवशोषित होता है।
मैंगनीज के अवशोषण का लोहे के अवशोषण से गहरा संबंध है। प्रति दिन मानव वजन के प्रति 1 किलोग्राम मैंगनीज की आवश्यकता 0.2-0.3 मिलीग्राम है। अधिकांश मैंगनीज क्रैनबेरी और चाय में पाया जाता है, चेस्टनट, कोको, सब्जियों, फलों (100-200 एमसीजी / 100 ग्राम) में थोड़ा कम।
^ निकेल। निकेल को अपेक्षाकृत हाल ही में एक आवश्यक ट्रेस तत्व के रूप में मान्यता दी गई है। वर्तमान में, लौह चयापचय की प्रक्रियाओं में एक कोएंजाइम के रूप में इसकी भूमिका स्थापित की गई है। इसी समय, शरीर में आयरन की मात्रा में वृद्धि के साथ-साथ भोजन निकल की आवश्यकता भी बढ़ जाती है। इसके अलावा, निकल तांबे के अवशोषण में योगदान देता है - हेमटोपोइजिस के लिए अपरिहार्य एक और तत्व। प्राकृतिक उत्पादों से अलग किए गए खाद्य निकल या निकल के महत्व को इस तथ्य से बल दिया जाता है कि इस तत्व के सिंथेटिक यौगिक कैंसरकारी होते हैं।
अधिकांश खाद्य पदार्थों में निकेल मौजूद होता है, लेकिन 1 मिलीग्राम/किग्रा से नीचे (और अक्सर बहुत कम) सांद्रता में। बताया गया है कि आहार में निकेल का सेवन 200 से 900 माइक्रोग्राम प्रति दिन से कम है। सामान्य आहार से लगभग 400 mcg/दिन आता है। यह दिखाया गया है कि वाइन और बीयर में निकेल की मात्रा क्रमशः 100 और 50 µg/L है।
जिंक.कोएंजाइम के रूप में यह ट्रेस तत्व प्रोटीन जैवसंश्लेषण (70 से अधिक) और न्यूक्लिक एसिड चयापचय (डीएनए प्रतिकृति और प्रतिलेखन की प्रक्रियाओं सहित) की प्रतिक्रियाओं की एक विस्तृत श्रृंखला में शामिल है, जो मुख्य रूप से शरीर के विकास और यौवन को सुनिश्चित करता है। साथ ही, जिंक, मैंगनीज के साथ, एक विशिष्ट ट्रेस तत्व है जो यौन क्रिया की स्थिति को प्रभावित करता है, अर्थात्, कुछ सेक्स हार्मोन की गतिविधि, शुक्राणुजनन, पुरुष गोनाड का विकास और माध्यमिक यौन विशेषताओं। इसके अलावा, हाल ही में प्रोस्टेट ग्रंथि में हाइपरट्रॉफिक प्रक्रियाओं की रोकथाम में जस्ता की भूमिका पर विचार किया गया है।
जिंक, सल्फर के साथ मिलकर त्वचा और बालों के विकास और नवीनीकरण में शामिल होता है। मैंगनीज और तांबे के साथ, जस्ता स्वाद और गंध संवेदनाओं की धारणा में महत्वपूर्ण योगदान देता है।जिंक एक अपरिहार्य घटक के रूप में इंसुलिन अणु का हिस्सा है, और मधुमेह के रोगियों में इसका स्तर कम हो जाता है। यह बहुत महत्वपूर्ण है कि यह ट्रेस तत्व अल्कोहल डिहाइड्रोजनेज का एक कोएंजाइम है, जो एथिल अल्कोहल के चयापचय को सुनिश्चित करता है। साथ ही, पुरानी शराब की लत में जिंक के अवशोषण का स्तर तेजी से कम हो जाता है। तथाकथित "रतौंधी" (यानी, रात्रि दृष्टि में कमी) न केवल विटामिन ए, बल्कि जिंक की अनुपस्थिति में भी विकसित हो सकती है। जिंक, विटामिन बी 6 के साथ मिलकर, असंतृप्त फैटी एसिड के चयापचय और प्रोस्टाग्लैंडीन के संश्लेषण को सुनिश्चित करता है।
जिंक पाचन और पोषक तत्वों के अवशोषण के लिए बहुत महत्वपूर्ण है। तो, जस्ता अग्न्याशय में सबसे महत्वपूर्ण पाचन एंजाइमों का संश्लेषण प्रदान करता है, और काइलोमाइक्रोन - परिवहन कणों के निर्माण में भी भाग लेता है, जिसमें आहार वसा को रक्त में अवशोषित किया जा सकता है। जिंक, विटामिन बी के साथ, तंत्रिका तंत्र के कार्यों का एक महत्वपूर्ण नियामक है। जिंक की कमी की स्थिति में, भावनात्मक विकार, भावनात्मक अस्थिरता, चिड़चिड़ापन और बहुत गंभीर मामलों में, अनुमस्तिष्क शिथिलता हो सकती है। अंत में, लिम्फोसाइटों की परिपक्वता और सेलुलर प्रतिरक्षा की प्रतिक्रियाओं की प्रक्रियाओं में जस्ता की भागीदारी के पक्ष में अधिक से अधिक डेटा जमा हो रहे हैं।
जिंक की दैनिक आवश्यकता 8000-22000 एमसीजी% है। वह सामान्य आहार से काफी संतुष्ट हैं। अकेले पीने के पानी के साथ जिंक का औसत दैनिक सेवन लगभग 400 एमसीजी है। खाद्य उत्पादों में जिंक की मात्रा आमतौर पर 150-25000 एमसीजी% तक होती है। हालाँकि, लीवर, मांस और फलियों में यह 3000 - 5000 mcg% तक पहुँच जाता है। कभी-कभी, उन बच्चों और किशोरों के शरीर में जिंक की कमी का अनुभव हो सकता है जो पर्याप्त पशु उत्पादों का सेवन नहीं करते हैं।
^ सेलेनियम। XX सदी के मध्य में भी। सेलेनियम को न केवल पोषण विज्ञान द्वारा नहीं माना गया था, बल्कि इसे कार्सिनोजेनिक गुणों वाला एक बहुत ही जहरीला तत्व भी माना गया था। हालाँकि, पहले से ही 60 के दशक में। ऐसा पाया गया कि सेलेनियम की कमी से हृदय प्रणाली प्रभावित होती है, जो प्रगतिशील एथेरोस्क्लेरोसिस और हृदय की मांसपेशियों की कमजोरी से प्रकट होता है, और पुरानी सेलेनियम की कमी की स्थिति में, लगभग लाइलाज कार्डियोमायोपैथी विकसित हो सकती है। हाल ही में, आधुनिक शोध के स्तर पर, प्राचीन चीनी चिकित्सा के एक महत्वपूर्ण अवलोकन की पुष्टि की गई है, जो दर्शाता हैशरीर में सेलेनियम का पर्याप्त प्रावधान उम्र बढ़ने की प्रक्रिया को धीमा करने में मदद करता है और दीर्घायु की ओर ले जाता है . यह ध्यान रखना दिलचस्प है कि स्वास्थ्य और दीर्घायु प्राप्त करने के लिए प्राचीन चीन में शाही महलों को आपूर्ति की जाने वाली हरी चाय की प्रसिद्ध औषधीय किस्में उन पहाड़ी प्रांतों में उगाई गईं, जिनकी मिट्टी में उच्च सेलेनियम सामग्री पहले से ही आधुनिक विश्लेषणात्मक तरीकों का उपयोग करके निर्धारित की जाती है। .
सेलेनियम की खोज के बाद, यह पाया गया कि विटामिन ई और सेलेनियम एक ही प्रक्रिया के विभिन्न भागों पर कार्य करते हैं और एक-दूसरे के लिए सख्ती से पूरक हैं, यानी, एक साथ उपयोग किए जाने पर उनकी एंटीऑक्सीडेंट गतिविधि नाटकीय रूप से बढ़ जाती है। दोनों एंटीऑक्सीडेंट का तालमेल कैंसर विरोधी गतिविधि के संदर्भ में विशेष रुचि रखता है। इस प्रकार, यह दिखाया गया कि विटामिन ई के साथ सेलेनियम की तैयारी के प्रशासन ने प्रयोगात्मक ट्यूमर के संबंध में कैंसर विरोधी प्रभाव में काफी वृद्धि की है।
भोजन के साथ सेलेनियम का सेवन भोजन सेवन की स्थितियों और प्रकृति और खाद्य उत्पादों में सेलेनियम के स्तर पर निर्भर करता है। अनाज, अनाज उत्पाद, मांस (विशेष रूप से उप-उत्पाद), समुद्री भोजन, जिनमें महत्वपूर्ण मात्रा में सेलेनियम होता है, के विपरीत, सब्जियां और फल आम तौर पर सेलेनियम का खराब स्रोत होते हैं। आम तौर पर 0.2 मिलीग्राम/किग्रा से अधिक गीला वजन . मिट्टी की रासायनिक संरचना और उसमें सेलेनियम की सामग्री अनाज में सेलेनियम की मात्रा को महत्वपूर्ण रूप से प्रभावित करती है, जो 0.04 मिलीग्राम/किग्रा से 21 मिलीग्राम/किग्रा तक भिन्न होती है।
मोलिब्डेनम.एक वयस्क के शरीर में मोलिब्डेनम की कुल मात्रा लगभग 7 मिलीग्राम होती है। रक्त में मोलिब्डेनम की मात्रा लगभग 0.5 माइक्रोग्राम प्रति 100 मिलीलीटर है। इस तत्व की उच्च सांद्रता उन क्षेत्रों में रहने वाले लोगों में पाई गई है जहां की मिट्टी इस धातु के यौगिकों से सबसे अधिक समृद्ध है। इस प्रकार, आर्मेनिया के कुछ क्षेत्रों में, मुख्य रूप से स्थानीय उत्पाद खाने वाले निवासियों में गाउट के लगातार मामले देखे गए हैं, जिनमें मोलिब्डेनम का अत्यधिक उच्च स्तर पाया गया है। इस क्षेत्र के निवासियों के आहार में इसकी सामग्री 10-15 मिलीग्राम थी। अन्य क्षेत्रों में जहां गठिया के मामले कम आम थे, लोगों को भोजन से प्रति दिन केवल 1-2 मिलीग्राम मोलिब्डेनम प्राप्त होता था।
मोलिब्डेनम कई एंजाइमों का एक अभिन्न अंग है, जैसे ज़ैंथिन ऑक्सीडेज, एल्डिहाइड ऑक्सीडेज, सल्फेट ऑक्सीडेज। यह ज्ञात है कि मोलिब्डेनम क्षय के विकास को रोकता है।
मोलिब्डेनम की अनुमानित दैनिक आवश्यकता शरीर के वजन के प्रति 1 किलो 2 एमसीजी है। रूस में, मोलिब्डेनम का दैनिक सेवन 0.27 मिलीग्राम है।
मोलिब्डेनम में सबसे समृद्ध विभिन्न प्रकार की सब्जियां (उदाहरण के लिए, फलियां) और जानवरों के आंतरिक अंग हैं।
कोबाल्ट.कोबाल्ट का जैविक प्रभाव 1948 से ज्ञात है, जब वैज्ञानिक रिकेस और स्मिथ ने पाया कि कोबाल्ट परमाणु विटामिन बी 12 अणु में केंद्रीय है। ऊतकों में कोबाल्ट की अधिकतम सांद्रता लगभग 100 μg/kg है। एक वयस्क के शरीर में कोबाल्ट की कुल मात्रा 5 मिलीग्राम है। प्रतिदिन भोजन करने वाले एक व्यक्ति को 5.63 -7.94 माइक्रोग्राम कोबाल्ट प्राप्त होता है, जिसमें से 73 - 97% अवशोषित हो जाता है।
कोबाल्ट की औसत दैनिक आवश्यकता शरीर के वजन के प्रति 1 किलो 60 एमसीजी है। ऐसा माना जाता है कि किसी व्यक्ति को कोबाल्ट की आवश्यकता केवल सायनोकोबालामिन (विटामिन बी 12) के रूप में होती है। कुछ देशों में, फोम को स्थिर करने के लिए कोबाल्ट यौगिकों का उपयोग बीयर में खाद्य योज्य के रूप में किया जाता है। हालाँकि, यह पता चला कि इस तरह का एक योजक बीयर उपभोक्ताओं में हृदय रोग का कारण था। इसलिए, अब खाद्य योज्य के रूप में कोबाल्ट यौगिकों का उपयोग बंद कर दिया गया है।
^
4 खाद्य पदार्थों की खनिज संरचना पर प्रसंस्करण का प्रभाव
खाद्य कच्चे माल को संसाधित करते समय, एक नियम के रूप में, खनिज पदार्थों की सामग्री में कमी होती है (खाद्य नमक के रूप में जोड़े गए Na को छोड़कर)। पौधों के खाद्य पदार्थों में, वे अपशिष्ट के साथ नष्ट हो जाते हैं। इस प्रकार, अनाज प्रसंस्करण के बाद अनाज और आटे के उत्पादन के दौरान कई मैक्रो- और विशेष रूप से सूक्ष्म तत्वों की सामग्री कम हो जाती है, क्योंकि पूरे अनाज की तुलना में हटाए गए गोले और रोगाणुओं में ये घटक अधिक होते हैं। उच्चतम ग्रेड के गेहूं के आटे और साबुत अनाज के आटे में खनिज संरचना का तुलनात्मक विश्लेषण नीचे दिया गया है (तत्वों की सामग्री उत्पाद के मिलीग्राम / 100 ग्राम में इंगित की गई है):

उदाहरण के लिए, औसतन, गेहूं और राई के दानों में लगभग 1.7% राख तत्व होते हैं, जबकि आटे में, विविधता के आधार पर, 0.5 (उच्चतम ग्रेड में) से 1.5% (पूरे भोजन में) तक होते हैं। सब्जियों और आलू को साफ करते समय 10 से 30% खनिज नष्ट हो जाते हैं। यदि उन्हें गर्मी में पकाया जाता है, तो प्रौद्योगिकी (खाना पकाने, तलने, स्टू करने) के आधार पर, 5 से 30% का नुकसान होता है।
मांस, मछली उत्पाद और पोल्ट्री में हड्डियों से गूदे को अलग करने के दौरान ज्यादातर कैल्शियम और फास्फोरस जैसे मैक्रोन्यूट्रिएंट्स खो जाते हैं।
थर्मल कुकिंग (उबालना, तलना, स्टू करना) के दौरान, मांस 5 से 50% तक खनिज खो देता है। हालाँकि, यदि प्रसंस्करण बहुत अधिक कैल्शियम वाली हड्डियों की उपस्थिति में किया जाता है, तो पके हुए मांस उत्पादों में कैल्शियम की मात्रा 20% तक बढ़ाना संभव है।
तकनीकी प्रक्रिया में, अपर्याप्त उच्च गुणवत्ता वाले उपकरणों के कारण, एक निश्चित मात्रा में सूक्ष्म तत्व अंतिम उत्पाद में जा सकते हैं। तो, रोटी बनाते समय आटा तैयार करते समय उपकरण के साथ आटे के संपर्क के परिणामस्वरूप लौह तत्व को 30% तक बढ़ाया जा सकता है। यह प्रक्रिया अवांछनीय है, क्योंकि धातु में अशुद्धियों के रूप में मौजूद जहरीले तत्व भी लोहे के साथ उत्पाद में प्रवेश कर सकते हैं।डिब्बाबंद भोजन को खराब गुणवत्ता वाले सोल्डर वाले पूर्वनिर्मित टिन (अर्थात् सोल्डर किए गए) डिब्बे में संग्रहीत करते समय या यदि सुरक्षात्मक लाह की परत टूट जाती है, तो सीसा, कैडमियम और टिन जैसे अत्यधिक जहरीले तत्व उत्पाद में प्रवेश कर सकते हैं।
यह ध्यान में रखा जाना चाहिए कि कई धातुएं, जैसे लोहा और तांबा, यहां तक कि छोटी सांद्रता में भी, उत्पादों के अवांछनीय ऑक्सीकरण का कारण बन सकते हैं। उनकी उत्प्रेरक ऑक्सीकरण क्षमताएं विशेष रूप से वसा और वसायुक्त उत्पादों के संबंध में स्पष्ट होती हैं। इसलिए, उदाहरण के लिए, मक्खन और मार्जरीन के दीर्घकालिक भंडारण के दौरान 1.5 मिलीग्राम/किलोग्राम से ऊपर लोहे और 0.4 मिलीग्राम/किलोग्राम तांबे की सांद्रता पर, ये धातुएं उत्पादों की बासीपन का कारण बनती हैं। 5 मिलीग्राम/लीटर से ऊपर आयरन और 1 मिलीग्राम/लीटर से ऊपर तांबे की उपस्थिति में पेय का भंडारण करते समय, कुछ शर्तों के तहत, पेय में अक्सर मैलापन देखा जा सकता है।
^
5. खनिज पदार्थों के निर्धारण की विधियाँ
खनिज पदार्थों के विश्लेषण के लिए मुख्य रूप से भौतिक रासायनिक विधियों का उपयोग किया जाता है - ऑप्टिकल और इलेक्ट्रोकेमिकल।
इनमें से लगभग सभी विधियों में विश्लेषण के लिए नमूनों की विशेष तैयारी की आवश्यकता होती है, जिसमें अध्ययन की वस्तु का प्रारंभिक खनिजकरण शामिल होता है। खनिजकरण दो तरीकों से किया जा सकता है: "सूखा" और "गीला"। "सूखा" खनिजकरण में कुछ शर्तों के तहत परीक्षण नमूने को जलाना, जलाना और शांत करना शामिल है। "गीले" खनिजकरण में केंद्रित एसिड (अक्सर एचएनओ 3 और एच 2 एसओ 4) के साथ अध्ययन की वस्तु का उपचार भी शामिल होता है।
^ विश्लेषण की वर्णक्रमीय विधियाँ।
फोटोइलेक्ट्रोक्लोरिमेट्री - स्पेक्ट्रम के दृश्य क्षेत्र में मोनोक्रोमैटिक विकिरण के रंगीन समाधानों द्वारा अवशोषण की माप पर आधारित विश्लेषण। नैरो-बैंड फिल्टर से सुसज्जित फोटोइलेक्ट्रिक कलरमीटर का उपयोग करके माप किए जाते हैं। यदि परीक्षण पदार्थ रंगीन नहीं है, तो इसे कुछ अभिकर्मकों (फोटोमेट्रिक विश्लेषणात्मक प्रतिक्रिया) के साथ रासायनिक प्रतिक्रिया द्वारा रंगीन यौगिक में परिवर्तित किया जाना चाहिए।
स्पेक्ट्रोफोटोमेट्री एक विश्लेषण विधि है जो स्पेक्ट्रम के पराबैंगनी, दृश्य और अवरक्त क्षेत्रों में मोनोक्रोमैटिक विकिरण के अवशोषण को मापने पर आधारित है। इस तरह के माप स्पेक्ट्रोफोटोमीटर का उपयोग करके किए जाते हैं, जहां फैलाने वाले प्रिज्म और विवर्तन झंझरी का उपयोग मोनोक्रोमैटाइज़र के रूप में किया जाता है।
अध्ययन के तहत आयन का मात्रात्मक विश्लेषण आमतौर पर अंशांकन वक्र विधि का उपयोग करके किया जाता है।
उत्सर्जन वर्णक्रमीय विश्लेषण.उत्सर्जन वर्णक्रमीय विश्लेषण के तरीके गैसीय अवस्था में किसी पदार्थ के परमाणुओं और आयनों द्वारा उत्सर्जित प्रकाश की तरंग दैर्ध्य, तीव्रता और अन्य विशेषताओं को मापने पर आधारित होते हैं। उत्सर्जन वर्णक्रमीय विश्लेषण अकार्बनिक और कार्बनिक पदार्थों की मौलिक संरचना को निर्धारित करना संभव बनाता है।
वर्णक्रमीय रेखा की तीव्रता उत्तेजना स्रोत में उत्तेजित परमाणुओं की संख्या से निर्धारित होती है, जो न केवल नमूने में तत्व की एकाग्रता पर निर्भर करती है, बल्कि उत्तेजना की स्थिति पर भी निर्भर करती है। उत्तेजना स्रोत के स्थिर संचालन के साथ, वर्णक्रमीय रेखा की तीव्रता और तत्व की एकाग्रता (यदि यह पर्याप्त रूप से कम है) के बीच संबंध रैखिक है, यानी, इस मामले में, अंशांकन वक्र का उपयोग करके मात्रात्मक विश्लेषण भी किया जा सकता है तरीका।
उत्तेजना के स्रोत के रूप में सबसे बड़ा अनुप्रयोग विद्युत चाप, चिंगारी, ज्वाला है। चाप का तापमान 5000 - 6000°C तक पहुँच जाता है। एक चाप में लगभग सभी तत्वों का स्पेक्ट्रम प्राप्त करना संभव है। स्पार्क डिस्चार्ज के साथ, 7000 - 10000 डिग्री सेल्सियस का तापमान विकसित होता है और सभी तत्व उत्तेजित होते हैं। लौ पर्याप्त उज्ज्वल और स्थिर उत्सर्जन स्पेक्ट्रम देती है। उत्तेजना स्रोत के रूप में लौ का उपयोग करके विश्लेषण की विधि को लौ उत्सर्जन विश्लेषण कहा जाता है। यह विधि चालीस से अधिक तत्वों (क्षारीय और क्षारीय पृथ्वी, Cu 2, Mn 2, आदि) को निर्धारित करती है।
^ परमाणु अवशोषण स्पेक्ट्रोस्कोपी . यह विधि प्रत्येक तत्व की तरंग दैर्ध्य पर प्रकाश ऊर्जा को अवशोषित करने के लिए ज्वाला गैसों में तत्वों के मुक्त परमाणुओं की क्षमता पर आधारित है।
परमाणु अवशोषण स्पेक्ट्रोस्कोपी में, विभिन्न तत्वों की वर्णक्रमीय रेखाओं के ओवरलैप होने की संभावना लगभग पूरी तरह से बाहर कर दी जाती है, क्योंकि स्पेक्ट्रम में उनकी संख्या उत्सर्जन स्पेक्ट्रोस्कोपी की तुलना में बहुत कम होती है।
परमाणु अवशोषण स्पेक्ट्रोस्कोपी की शर्तों के तहत गुंजयमान विकिरण की तीव्रता में कमी, बाउगुएर-लैम्बर्ट-बीयर कानून के समान, परत की मोटाई और पदार्थ की एकाग्रता के आधार पर तीव्रता में कमी के घातीय कानून का पालन करती है।
प्रकाश-अवशोषित परत (लौ) की मोटाई की स्थिरता एक विशेष डिजाइन के बर्नर का उपयोग करके प्राप्त की जाती है। परमाणु अवशोषण वर्णक्रमीय विश्लेषण के तरीकों का व्यापक रूप से लगभग किसी भी तकनीकी या प्राकृतिक वस्तु के विश्लेषण के लिए उपयोग किया जाता है, खासकर उन मामलों में जहां तत्वों की छोटी मात्रा निर्धारित करना आवश्यक होता है।
70 से अधिक तत्वों के लिए परमाणु अवशोषण निर्धारण के तरीके विकसित किए गए हैं।
^ 2. विश्लेषण की विद्युतरासायनिक विधियाँ।
आयनोमेट्री। इस विधि का उपयोग K आयनों को निर्धारित करने के लिए किया जाता है , ना , सीए 2 , एम.एन 2 , एफ - , मैं - , सीएल - वगैरह।
विधि आयन-चयनात्मक इलेक्ट्रोड के उपयोग पर आधारित है, जिसकी झिल्ली एक निश्चित प्रकार के आयनों के लिए पारगम्य है (इसलिए, एक नियम के रूप में, विधि की उच्च चयनात्मकता)।
निर्धारित किए जा रहे आयन की मात्रात्मक सामग्री या तो एक अंशांकन ग्राफ का उपयोग करके की जाती है, जिसे निर्देशांक ई - पीसी में प्लॉट किया जाता है, या परिवर्धन की विधि द्वारा। विदेशी पदार्थों की उच्च सांद्रता वाली जटिल प्रणालियों में आयनों के निर्धारण के लिए मानक जोड़ विधि की सिफारिश की जाती है।
पोलरोग्राफी.विषैले तत्वों (पारा, कैडमियम, सीसा, तांबा, लोहा) को निर्धारित करने के लिए प्रत्यावर्ती धारा पोलारोग्राफी की विधि का उपयोग किया जाता है।
यह विधि इलेक्ट्रोऑक्सीडाइजिंग या इलेक्ट्रोरेड्यूसिंग पदार्थ के इलेक्ट्रोलिसिस के दौरान प्राप्त वर्तमान-वोल्टेज वक्रों के अध्ययन पर आधारित है। पोलारोग्राफी में एक संकेतक इलेक्ट्रोड के रूप में, पारा ड्रॉप इलेक्ट्रोड का सबसे अधिक उपयोग किया जाता है, कभी-कभी ठोस माइक्रोइलेक्ट्रोड - प्लैटिनम, ग्रेफाइट। संदर्भ इलेक्ट्रोड के रूप में, या तो इलेक्ट्रोलाइज़र के तल पर पारा डाला जाता है या संतृप्त कैलोमेल आधा सेल का उपयोग किया जाता है।
जैसे-जैसे वोल्टेज बढ़ता है, एक क्षण आता है जब प्रसार के कारण इलेक्ट्रोड में प्रवेश करने वाले सभी आयन तुरंत डिस्चार्ज हो जाते हैं और निकट-इलेक्ट्रोड परत में उनकी एकाग्रता स्थिर और व्यावहारिक रूप से शून्य के बराबर हो जाती है। इस समय परिपथ में प्रवाहित धारा को सीमित प्रसार धारा कहा जाता है।
मात्रात्मक ध्रुवीय विश्लेषण निर्धारित किए जा रहे तत्व की सांद्रता पर प्रसार धारा की प्रत्यक्ष आनुपातिक निर्भरता के उपयोग पर आधारित है।
^ खनिज तत्व
खाद्य उत्पादों में खनिज (राख) तत्व कार्बनिक और अकार्बनिक यौगिकों के रूप में पाए जाते हैं। ये कई कार्बनिक पदार्थों में पाए जाते हैं
विभिन्न वर्गों के पदार्थ - प्रोटीन, वसा, ग्लाइकोसाइड, एंजाइम इत्यादि। आम तौर पर, खनिज तत्व खाद्य उत्पादों के दहन के बाद राख में निर्धारित होते हैं, क्योंकि यह निर्धारित करना काफी मुश्किल है कि कौन से पदार्थ और किस मात्रा में ये तत्व शामिल हैं।
मनुष्यों, जानवरों और पौधों के जीवन में खनिज तत्वों की भूमिका बहुत बड़ी है: जीवित जीवों में सभी शारीरिक प्रक्रियाएं इन तत्वों की भागीदारी से आगे बढ़ती हैं। इस प्रकार, मानव और पशु शरीर में, खनिज तत्व प्लास्टिक प्रक्रियाओं, ऊतकों के निर्माण और निर्माण में, जल चयापचय में, रक्त और अन्य शरीर के तरल पदार्थों के आसमाटिक दबाव को बनाए रखने में, शरीर में एसिड-बेस संतुलन बनाए रखने में शामिल होते हैं। और उन पदार्थों के परिसर में शामिल हैं जो जीवित प्रोटोप्लाज्म कोशिकाओं को बनाते हैं, कुछ अंतःस्रावी ग्रंथियों आदि की संरचना में।
जीवों की खनिज संरचना उम्र के साथ बदलती रहती है; उम्र बढ़ने के साथ, जीवों का खनिजकरण देखा जाता है। तो, नवजात शिशुओं में शरीर के वजन के प्रति 1 किलोग्राम में लगभग 34 ग्राम खनिज होते हैं, एक वयस्क में, इन पदार्थों की सामग्री 43 ग्राम या उससे अधिक तक बढ़ जाती है।
मानव और पशु शरीर में 70 से अधिक खनिज तत्व पाए गए हैं। शरीर के विभिन्न ऊतकों में होने वाली कई एंजाइमेटिक प्रक्रियाओं के लिए कई खनिज तत्वों की भागीदारी की आवश्यकता होती है। तो, पाइरुविक एसिड को एसिटिक एसिड में या ग्लूकोज को फ्रुक्टोज में या फॉस्फोग्लिसरॉल को ग्लूकोज-6-मैनोज-6- और फ्रुक्टोज-6-फॉस्फेट में बदलने के लिए, मैग्नीशियम आयनों की भागीदारी अनिवार्य है। कैल्शियम आयन इस प्रक्रिया के विकास को रोकते हैं।
मानव शरीर के ऊतकों में खनिज असमान रूप से वितरित होते हैं। कठोर ऊतकों में, द्विसंयोजक तत्व प्रबल होते हैं: कैल्शियम (Ca) और मैग्नीशियम (Mg), और नरम ऊतकों में - मोनोवैलेंट तत्व: पोटेशियम (K) और सोडियम (Na)। इसके अलावा, बहुत सारा फॉस्फोरस (पी) कठोर ऊतकों में जमा हो जाता है, मुख्यतः फॉस्फेट लवण के रूप में। भोजन में खनिजों की कमी से, ये यौगिक शरीर से बाहर निकल जाते हैं और सामान्य चयापचय गड़बड़ा जाता है।
रक्त प्लाज्मा, अंतरकोशिकीय और शरीर के अन्य तरल पदार्थों में घुले खनिज पदार्थ एक निश्चित आसमाटिक दबाव बनाते हैं, जो तरल में घुले पदार्थों की दाढ़ सांद्रता पर निर्भर करता है। लवण आसमाटिक दबाव को काफी हद तक बढ़ा देते हैं
समान दाढ़ सांद्रता पर गैर-इलेक्ट्रोलाइट्स की तुलना में डिग्री, क्योंकि लवण आयन बनाने के लिए अलग हो जाते हैं। आसमाटिक दबाव असंबद्ध अणुओं और आयनों की कुल संख्या पर निर्भर करता है। मानव और पशु शरीर के रक्त, लसीका और अंतरकोशिकीय द्रव का आसमाटिक दबाव मुख्य रूप से उनमें घुले सोडियम क्लोराइड (NaCl) पर निर्भर करता है।
शरीर के तरल पदार्थों में आसमाटिक दबाव ऊतकों में पानी और विलेय के वितरण को प्रभावित करता है। उच्चतर जानवरों में, आसमाटिक दबाव स्थिर होता है और इसकी मात्रा 7.5 - 9.0 एटीएम होती है। निरंतर आसमाटिक दबाव बनाए रखना उत्सर्जन अंगों, मुख्य रूप से गुर्दे और पसीने की ग्रंथियों की गतिविधि द्वारा सुनिश्चित किया जाता है।
रक्त में खनिज लवणों के प्रवेश से अंतरकोशिकीय जल रक्त में प्रवेश करता है, और इसलिए रक्त में नमक की सांद्रता कम हो जाती है। फिर अतिरिक्त पानी और नमक गुर्दे द्वारा निकाल दिया जाता है। ऊतकों में पानी की कमी, तंत्रिका केंद्रों पर प्रतिवर्ती प्रभाव डालती है, जिससे प्यास लगती है।
मानव शरीर की सामान्य महत्वपूर्ण गतिविधि अंतरकोशिकीय और अंतरालीय तरल पदार्थों के कुछ गुणों के साथ ही आगे बढ़ सकती है। पर्यावरण की इस स्थिरता में एसिड-बेस बैलेंस एक महत्वपूर्ण भूमिका निभाता है, जिसमें रक्त, लसीका और शरीर के अन्य तरल पदार्थों की प्रतिक्रिया तटस्थ के करीब होती है। केंद्रीय तंत्रिका तंत्र द्वारा एक पूरे में संयुक्त नियामकों की एक जटिल प्रणाली के कारण एसिड-बेस संतुलन बनाए रखा जाता है। ऐसे नियामक रक्त बफर सिस्टम, ऑक्सीजन और कार्बन डाइऑक्साइड का आदान-प्रदान, कार्बन डाइऑक्साइड और क्लोराइड लवण, गुर्दे, फेफड़े, पसीने की ग्रंथियों आदि के उत्सर्जन कार्य हैं।
कैल्शियम, मैग्नीशियम, सोडियम या पोटेशियम से भरपूर खाद्य पदार्थों के मानव शरीर में जटिल परिवर्तन की प्रक्रिया में क्षारीय यौगिक बन सकते हैं। क्षार बनाने वाले तत्वों के स्रोतों में फल, सब्जियाँ, फलियाँ, दूध और डेयरी उत्पाद शामिल हैं।
अन्य उत्पाद, जैसे मांस, मछली, अंडे, पनीर, ब्रेड, अनाज, पास्ता, मानव शरीर में परिवर्तन की प्रक्रिया में अम्लीय यौगिक देते हैं।
पोषण की प्रकृति मानव शरीर के ऊतकों में एसिड-बेस संतुलन में बदलाव को प्रभावित कर सकती है। अम्ल-क्षार संतुलन अक्सर अम्लता के पक्ष में बदल जाता है। एक तीव्र बदलाव के परिणामस्वरूप
राख सामग्री के लिए स्वीकार्य अधिकतम मानक, और ऐसे उत्पादों का मूल्यांकन करते समय, वे इसकी मात्रा निर्धारित करते हैं।
आमतौर पर, दो अवधारणाएँ प्रतिष्ठित हैं - "कुल (कच्ची) राख" और "शुद्ध राख"। "कुल राख" की अवधारणा का अर्थ है खनिज तत्वों या उनके ऑक्साइड का योग जो खाद्य उत्पादों की रासायनिक संरचना का हिस्सा है, साथ ही इसके उत्पादन के दौरान उत्पाद में पेश किया जाता है या "अशुद्धि से अशुद्धियों के रूप में पकड़ा जाता है। "शुद्ध राख" का अर्थ है अशुद्धियों के बिना खनिज तत्वों या उनके आक्साइड का योग।
उत्पाद की राख की मात्रा जलने से निर्धारित होती है। ऐसा करने के लिए, नमूने को पहले सावधानीपूर्वक जलाया जाता है, और फिर स्थिर वजन तक शांत किया जाता है। मानक के विपरीत राख की बढ़ी हुई मात्रा उत्पाद के रेत, धातु के कणों और पृथ्वी से दूषित होने का संकेत देती है।
"शुद्ध राख" निर्धारित करने के लिए, परिणामी राख को 10% हाइड्रोक्लोरिक एसिड से उपचारित किया जाता है। इस मामले में, "शुद्ध राख" हाइड्रोक्लोरिक एसिड में घुल जाती है, और अवशेष उत्पाद में विदेशी अकार्बनिक अशुद्धियों की उपस्थिति का संकेत देगा। तो, प्रसंस्करण से पहले टमाटर की खराब धुलाई के मामले में, या आलू स्टार्च में, कंदों की अपर्याप्त धुलाई के साथ, परमाणु उत्पाद में बाहरी खनिज अशुद्धियों के कारण राख की बढ़ी हुई मात्रा होती है।
मानव शरीर में कैल्शियम हड्डी के ऊतकों और दांतों में पाया जाता है - लगभग 99%। शेष कैल्शियम आयनों के रूप में और प्रोटीन तथा अन्य यौगिकों से संबद्ध अवस्था में रक्त में प्रवेश करता है।
एक वयस्क की कैल्शियम की दैनिक आवश्यकता 0.8-1.0 ग्राम है। गर्भवती और स्तनपान कराने वाली महिलाओं को प्रति दिन 1.5-2 ग्राम तक कैल्शियम की बढ़ी हुई मात्रा की आवश्यकता होती है, साथ ही जिन बच्चों के शरीर में कैल्शियम का उपयोग हड्डियों के निर्माण के लिए गहनता से किया जाता है। कैल्शियम की कमी से शरीर में कंकाल विकृति, हड्डी की कमजोरी और मांसपेशी शोष होता है। कैल्शियम की विशेषता यह है कि भोजन में इसकी कमी होने पर भी यह शरीर से काफी मात्रा में उत्सर्जित होता रहता है।
कैल्शियम खाद्य उत्पादों में फॉस्फेट और ऑक्सालेट क्लोराइड लवण के रूप में, साथ ही फैटी एसिड, प्रोटीन आदि के संयोजन में पाया जाता है।
सीएसी! ए को छोड़कर, सभी कैल्शियम यौगिक पानी में मुश्किल से घुलनशील होते हैं, और इसलिए खराब अवशोषित होते हैं
मानव शरीर। गैस्ट्रिक जूस के हाइड्रोक्लोरिक एसिड की क्रिया के तहत अघुलनशील कैल्शियम यौगिक आंशिक रूप से उत्पादों से पेट में घोल में चले जाते हैं। मानव शरीर द्वारा खाद्य उत्पादों में कैल्शियम का अवशोषण काफी हद तक भोजन में फॉस्फेट, वसा, मैग्नीशियम यौगिकों आदि की उपस्थिति पर निर्भर करता है। इस प्रकार, भोजन में कैल्शियम और फास्फोरस I का अनुपात होने पर कैल्शियम का अवशोषण सबसे अधिक होता है। ; 1.5 या 1:2. संकेतित अनुपात के विपरीत भोजन में फास्फोरस की मात्रा बढ़ने से कैल्शियम के अवशोषण में तेज कमी आती है। मैग्नीशियम की अधिकता मानव शरीर द्वारा कैल्शियम के अवशोषण पर भी प्रतिकूल प्रभाव डालती है। इनोसिटोल-फॉस्फोरिक एसिड के साथ कैल्शियम यौगिकों द्वारा कैल्शियम के अवशोषण पर तीव्र नकारात्मक प्रभाव डाला जाता है, जो अनाज के अनाज और इसके प्रसंस्करण के उत्पादों में महत्वपूर्ण मात्रा में पाया जाता है।
विटामिन डी कैल्शियम के अवशोषण में बहुत महत्वपूर्ण भूमिका निभाता है, जो आंतों से कैल्शियम और फास्फोरस लवणों के रक्त में संक्रमण और कैल्शियम फॉस्फेट के रूप में हड्डियों में जमाव को बढ़ावा देता है।
कुछ खाद्य उत्पादों में कैल्शियम की मात्रा इस प्रकार है (मिलीग्राम%): दुबले मांस में - 7; अंडे में - 54; दूध में - 118; पनीर में - 930; पनीर में - 140; दलिया में - 65; गेहूं के आटे में - 15; चावल में - 9; सेब में - 7; संतरे में - 45; अखरोट में -89; चुकंदर में - 29; फूलगोभी में - 89; सफेद गोभी में - 45; गाजर में - 56; आलू में - 14. उपरोक्त आंकड़ों से पता चलता है कि मनुष्य के लिए कैल्शियम का सबसे महत्वपूर्ण स्रोत डेयरी उत्पाद हैं। डेयरी उत्पादों, साथ ही सब्जियों और फलों में कैल्शियम आसानी से पचने योग्य यौगिक है।
मानव शरीर में मैग्नीशियम कैल्शियम से 30-35 गुना कम होता है, लेकिन यह बहुत महत्वपूर्ण है। अधिकांश मैग्नीशियम अस्थि ऊतक में पाया जाता है। क्लोरोफिल धारण करने वाले पौधों में मैग्नीशियम एक विशेष भूमिका निभाता है, जहां यह क्लोरोफिल अणु का हिस्सा है। कैल्शियम की तरह, मैग्नीशियम अल्प घुलनशील यौगिक बनाता है। एलओ$ आयन की उपस्थिति में मैग्नीशियम को आत्मसात करना विशेष रूप से कठिन होता है।
कुछ खाद्य उत्पादों में मैग्नीशियम की मात्रा इस प्रकार है (मिलीग्राम%): बीन्स में - 139; दलिया में - 133; मटर में - 107; बाजरा में - 87; गेहूं की रोटी में - 30; आलू में - 28; गाजर में - 21; सफेद गोभी में -!अन्ना - 12; सेब में - 8; नींबू में - 7; गोमांस में - 15; अंडे में - 11; दूध में - 12. परिणामस्वरूप, अनाज और फलियों में 2*35 मैग्नीशियम सबसे अधिक मात्रा में पाया जाता है।
एक वयस्क के लिए मैग्नीशियम की आवश्यकता प्रति दिन 400 मिलीग्राम है।
सोडियम खाद्य पदार्थों, विशेषकर पशु उत्पादों में व्यापक रूप से पाया जाता है। मानव शरीर के लिए सोडियम का मुख्य स्रोत NaCt (सामान्य नमक) है। सोडियम इंट्रासेल्युलर और इंटरटिशू चयापचय की प्रक्रियाओं में एक महत्वपूर्ण भूमिका निभाता है। रक्त प्लाज्मा का लगभग 90% आसमाटिक दबाव इसमें NaCl की सामग्री पर निर्भर करता है। आमतौर पर, एक लीटर मानव रक्त प्लाज्मा में 3.3 ग्राम सोडियम घुल जाता है। NaC! यह शरीर के जल चयापचय को विनियमित करने में भी महत्वपूर्ण भूमिका निभाता है। सोडियम आयन ऊतक कोलाइड्स की सूजन का कारण बनते हैं और इस तरह शरीर में बंधे पानी को बनाए रखने में योगदान करते हैं। NaC के शरीर से! मुख्य रूप से मूत्र और पसीने में उत्सर्जित होता है। बढ़ते काम और तरल पदार्थों के सेवन से एक व्यक्ति 3-5 लीटर तक पसीना बहाता है, जो कि 99.5% पानी होता है। पसीने के शुष्क पदार्थ में मुख्य भाग NaGI होता है।
टेबल नमक, जो भोजन के साथ मानव शरीर में प्रवेश करता है, रक्त में NaCl की खपत को पूरा करता है और गैस्ट्रिक जूस में हाइड्रोक्लोरिक एसिड बनाने के साथ-साथ अग्न्याशय ग्रंथि द्वारा NaHCO3 को संश्लेषित करने के लिए उपयोग किया जाता है। NaHCO3 की उपस्थिति अग्नाशयी रस की क्षारीय प्रतिक्रिया की व्याख्या करती है, जो एंजाइम ट्रिप्सिन द्वारा खाद्य प्रोटीन के टूटने के लिए आवश्यक है।
एक वयस्क की सोडियम की दैनिक आवश्यकता 4-6 ग्राम है, जो 10-15 ग्राम टेबल नमक के बराबर है। जनसंख्या के सामान्य आहार में पर्याप्त मात्रा में सोडियम होता है, क्योंकि भोजन में टेबल नमक मिलाया जाता है।
पोटेशियम लगातार और महत्वपूर्ण मात्रा में खाद्य उत्पादों में मौजूद होता है, खासकर पौधों की उत्पत्ति के। पौधों की राख में, पोटेशियम की मात्रा कभी-कभी उसके द्रव्यमान का 50% से अधिक होती है।
मानव शरीर में, पोटेशियम एंजाइमेटिक प्रतिक्रियाओं में शामिल होता है, बफर सिस्टम का निर्माण होता है जो पर्यावरण की प्रतिक्रिया में बदलाव को रोकता है। पोटैशियम कम हो जाता है
प्रोटीन की जल-धारण क्षमता, उनकी जल-(क्षमता) को कम करती है, और इस प्रकार शरीर से पानी और सोडियम के उत्सर्जन को बढ़ावा देती है। इसलिए, पोटेशियम को कुछ शारीरिक सोडियम प्रतिपक्षी माना जा सकता है।
एक वयस्क की पोटेशियम की दैनिक आवश्यकता 3-5 ग्राम है।
लोहा प्रकृति में व्यापक रूप से वितरित है। आमतौर पर, लगभग सभी प्राकृतिक खाद्य पदार्थों में आयरन होता है, लेकिन कम मात्रा में।
मानव और पशु जीवों में, लोहा सबसे महत्वपूर्ण कार्बनिक यौगिकों का हिस्सा है - रक्त हीमोग्लोबिन, मायोग्लोबिन, कुछ एंजाइम - कैटालेज, पेरोक्सीडेज, साइटोक्रोम ऑक्सीडेज, आदि। रक्त हीमोग्लोबिन में 2 ए, शरीर का लोहा होता है। प्लीहा और यकृत में काफी मात्रा में आयरन पाया जाता है। आयरन में शरीर में जमा होने की क्षमता होती है। रक्त में हीमोग्लोबिन जीवन के दौरान नष्ट हो जाता है, और इस मामले में जारी लोहे को हीमोग्लोबिन बनाने के लिए शरीर द्वारा पुन: उपयोग किया जा सकता है।
आयरन, जो फलों और सब्जियों का हिस्सा है, मानव शरीर द्वारा अच्छी तरह से अवशोषित होता है, जबकि अनाज उत्पादों में अधिकांश आयरन शरीर के लिए अपचनीय रूप में होता है।
एक वयस्क मानव ग्रंथि की दैनिक आवश्यकता 15 मिलीग्राम है।
एल एल या आर कम मात्रा में प्राकृतिक खाद्य पदार्थों का एक हिस्सा है। वनस्पति उत्पादों में थोड़ा क्लोरीन होता है, जबकि पशु उत्पादों में थोड़ा अधिक होता है। तो, गोमांस में क्लोरीन की मात्रा 76 मिलीग्राम% है, दूध में - 106, अंडे में -
37106, पनीर में - 880, बाजरा में - 19, आलू में - 54, सेब में - 5 मिलीग्राम%।
क्लोरीन की मात्रा रक्त और शरीर के अन्य तरल पदार्थों के साथ-साथ त्वचा, फेफड़ों और गुर्दे में भी महत्वपूर्ण है। शरीर में क्लोरीन सोडियम, पोटेशियम, कैल्शियम, मैग्नीशियम, मैंगनीज के लवणों के आयनों के रूप में आयनित अवस्था में होता है। खाद्य उत्पादों में क्लोरीन के यौगिक अत्यधिक घुलनशील होते हैं और मानव आंत में आसानी से अवशोषित हो जाते हैं। क्लोरीन आयन, सोडियम धनायनों के साथ मिलकर, रक्त और शरीर के अन्य तरल पदार्थों के आसमाटिक दबाव को बनाने और विनियमित करने में महत्वपूर्ण भूमिका निभाते हैं। क्लोरीन लवण गैस्ट्रिक म्यूकोसा द्वारा हाइड्रोक्लोरिक एसिड का निर्माण प्रदान करते हैं।
क्लोरीन की मुख्य आवश्यकता सोडियम क्लोराइड से पूरी होती है, जिसे नमक के रूप में भोजन में मिलाया जाता है।
मानव शरीर में सोडियम क्लोराइड की कुल मात्रा आमतौर पर 10-15 ग्राम होती है, लेकिन क्लोरीन लवण से भरपूर भोजन खाने पर मानव शरीर में क्लोरीन की मात्रा अधिक मात्रा तक पहुंच सकती है। क्लोरीन की दैनिक मानव आवश्यकता 5-7 ग्राम है।
अनाज उत्पादों, फलियां, डेयरी उत्पाद, मांस, मछली और विशेष रूप से अंडे में सल्फर सबसे अधिक मात्रा में पाया जाता है। यह मानव शरीर के लगभग सभी प्रोटीनों का हिस्सा है और विशेष रूप से अमीनो एसिड - सिस्टीन, मेथिओनिन में प्रचुर मात्रा में होता है। शरीर में सल्फर का आदान-प्रदान मुख्य रूप से संकेतित अमीनो एसिड में इसका परिवर्तन है। यह विटामिन बीजी (थियामिन), इंसुलिन और कुछ अन्य यौगिकों के निर्माण में भी शामिल है। सहायक ऊतकों के प्रोटीनोइड्स में बहुत अधिक सल्फर होता है, उदाहरण के लिए, बालों, नाखूनों आदि के केराटिन में।
जब शरीर में यौगिकों का ऑक्सीकरण होता है, तो सल्फर का एक महत्वपूर्ण हिस्सा सल्फ्यूरिक एसिड लवण के रूप में मूत्र में उत्सर्जित होता है।
मध्यम कार्य वाले एक वयस्क की सल्फर की दैनिक आवश्यकता लगभग 1 ग्राम है।
70 किलोग्राम वजन वाले एक स्वस्थ व्यक्ति के शरीर में लगभग 25 मिलीग्राम की मात्रा में आयोडीन मौजूद होता है। इसकी आधी मात्रा थायरॉयड ग्रंथि में होती है, और बाकी मांसपेशियों और हड्डियों के ऊतकों और रक्त में होती है। थायरॉयड ग्रंथि में अकार्बनिक यौगिकों के आयोडीन को कार्बनिक यौगिकों द्वारा प्रतिस्थापित किया जाता है - थायरोक्सिन, डाय-आयोडोथायरोक्सिन, ट्राईआयोडोथायरोक्सिन। आयोडीन थायरॉयड ग्रंथि द्वारा जल्दी अवशोषित हो जाता है और इसमें प्रवेश करने के कुछ घंटों बाद यह कार्बनिक में बदल जाता है
सम्बन्ध। ये यौगिक शरीर में चयापचय प्रक्रियाओं को उत्तेजित करते हैं। जब आयोडीन की अपर्याप्त मात्रा भोजन के साथ शरीर में प्रवेश करती है, तो थायरॉयड ग्रंथि की गतिविधि बाधित हो जाती है और एंडेमिक गोइटर नामक एक गंभीर बीमारी विकसित हो जाती है।
आयोडीन की सबसे बड़ी मात्रा तटीय क्षेत्रों के पौधों और पशु उत्पादों में पाई जाती है, जहां यह समुद्र के पानी, हवा और तटीय क्षेत्रों की मिट्टी में केंद्रित है। पहाड़ी या समुद्री तट से दूर के क्षेत्रों के पौधों और जानवरों के जीवों में आयोडीन की थोड़ी सी मात्रा जमा हो जाती है।
अनाज उत्पादों, सब्जियों, मीठे पानी की मछली में आयोडीन की मात्रा कच्चे उत्पाद के प्रति 100 ग्राम 5-8 एमसीजी से अधिक नहीं होती है। गोमांस, अंडे, मक्खन, फलों में आयोडीन की मात्रा अधिक होती है। समुद्री केल, समुद्री मछली और मछली के तेल में सबसे अधिक मात्रा में आयोडीन होता है। जॉर्जिया के काला सागर तट पर उगने वाले फीजोआ फलों में प्रति 100 ग्राम फल द्रव्यमान में 390 माइक्रोग्राम आयोडीन जमा होता है, जो अन्य फलों और सब्जियों में इस तत्व की सामग्री से काफी अधिक है।
उन क्षेत्रों में जहां खाद्य उत्पादों में आयोडीन की अपर्याप्त मात्रा होती है, वहां टेबल नमक में 25 ग्राम K1 प्रति टन टेबल नमक की दर से पोटेशियम आयोडाइड मिलाया जाता है। सामान्य आहार में एक व्यक्ति प्रतिदिन 200 माइक्रोग्राम आयोडीन आयोडीन युक्त नमक के साथ खाता है। हालाँकि, आयोडीन युक्त नमक का भंडारण करते समय, आयोडीन धीरे-धीरे गायब हो जाता है, इसलिए 6 महीने के बाद आयोडीन युक्त नमक को साधारण टेबल नमक के रूप में बेचा जाता है।
आयोडीन की दैनिक मानव आवश्यकता 100-260 एमसीजी है।
हड्डी के ऊतकों और दांतों के इनेमल के निर्माण के दौरान प्लास्टिक प्रक्रियाओं में फ्लोरीन एक महत्वपूर्ण भूमिका निभाता है। फ्लोरीन की सबसे बड़ी मात्रा हड्डियों में केंद्रित होती है - 200-490 मिलीग्राम/किग्रा और दांतों में - 240-560 मिलीग्राम/किग्रा।
पानी मानव शरीर में फ्लोराइड का मुख्य स्रोत प्रतीत होता है, डोडा का फ्लोराइड भोजन के फ्लोराइड की तुलना में बेहतर अवशोषित होता है। पीने के पानी में फ्लोरीन की मात्रा 1 से 1.5 मिलीग्राम/लीटर तक होती है। पानी में फ्लोरीन की कमी अक्सर प्रभावित करती है
दांतों की एक बीमारी के विकास के लिए 39nne, जिसे क्षय के रूप में जाना जाता है। पानी में फ्लोरीन की अधिकता से फ्लोरोसिस हो जाता है, जिसमें दांतों की सामान्य संरचना गड़बड़ा जाती है, इनेमल पर दाग पड़ जाते हैं और दांतों की नाजुकता बढ़ जाती है। बच्चे विशेष रूप से फ्लोरीन की कमी या अधिकता से पीड़ित होते हैं।
फ्लोरीन की दैनिक मानव आवश्यकता अभी तक स्थापित नहीं हुई है। ऐसा माना जाता है कि स्वास्थ्य के लिए पीने के पानी में फ्लोराइड की इष्टतम मात्रा 0.5-1.2 मिलीग्राम/लीटर होनी चाहिए।
जानवरों के शरीर में तांबा, लोहे के साथ, हेमटोपोइजिस की प्रक्रियाओं में एक महत्वपूर्ण भूमिका निभाता है, ऑक्सीडेटिव प्रक्रियाओं को उत्तेजित करता है और इस प्रकार लोहे के चयापचय से जुड़ा होता है। यह धातु घटक के रूप में एंजाइमों (लैक्टेज, एस्कॉर्बेट ऑक्सीडेज, साइटोक्रोम ऑक्सीडेज, आदि) का हिस्सा है।
पौधों में, तांबा ऑक्सीडेटिव प्रक्रियाओं को बढ़ाता है, विकास में तेजी लाता है और कई फसलों की उपज बढ़ाता है।
प्राकृतिक उत्पादों में जितनी कम मात्रा में तांबा पाया जाता है, वह मानव शरीर को नुकसान नहीं पहुंचाता है। लेकिन तांबे की बढ़ी हुई मात्रा विषाक्तता का कारण बन सकती है। तो, 77-120 मिलीग्राम तांबे का एक साथ सेवन मतली, उल्टी और कभी-कभी दस्त का कारण बन सकता है। इसलिए, खाद्य उत्पादों में तांबे की सामग्री यूएसएसआर के स्वास्थ्य मंत्रालय के मौजूदा नियमों द्वारा नियंत्रित होती है। प्रति 1 किलो उत्पाद में, इसमें ठोस पदार्थों की मात्रा के आधार पर, 5 से 30 मिलीग्राम तांबे की अनुमति है। तो, केंद्रित टमाटर के पेस्ट में तांबे की मात्रा 30 मिलीग्राम / किग्रा से अधिक नहीं होनी चाहिए, टमाटर प्यूरी में - 15-20, डिब्बाबंद सब्जियों में - 10, जैम और मुरब्बा में - 10, फलों के मिश्रण में - 5 मिलीग्राम / किग्रा।
तांबा खाद्य उत्पादों में उनके निर्माण के दौरान मिल सकता है - उपकरण के तांबे के हिस्सों से, जब अंगूर के बागानों को तांबा युक्त कीटनाशकों से उपचारित किया जाता है, आदि।
एक वयस्क की तांबे की दैनिक आवश्यकता 2 मिलीग्राम है।
जिंक जानवरों और पौधों के सभी ऊतकों में पाया जाता है। युवा महिलाओं के शरीर में जिंक की कमी के साथ,
पौधों में उनकी वृद्धि में देरी होती है और मिट्टी में इसकी कमी से कई पौधों में रोग उत्पन्न हो जाते हैं, जिससे अक्सर उनकी मृत्यु हो जाती है।
जिंक कई एंजाइमों का हिस्सा है, और कार्बोनिक एनहाइड्रेज़ एंजाइम अणु में इसकी भूमिका, जो जानवरों के शरीर से कार्बन डाइऑक्साइड के बंधन और उत्सर्जन में शामिल है, विशेष रूप से महत्वपूर्ण है। जिंक पिट्यूटरी, अधिवृक्क और अग्नाशयी हार्मोन के सामान्य कार्य के लिए आवश्यक है। यह वसा के चयापचय पर भी प्रभाव डालता है, वसा के टूटने को बढ़ाता है और फैटी लीवर को रोकता है।
खाद्य पदार्थों में अधिक मात्रा में जिंक विषाक्तता का कारण बन सकता है। अम्लीय और वसायुक्त खाद्य पदार्थ धात्विक जिंक को घोल देते हैं, और इसलिए जिंक उपकरण या बर्तनों में भोजन पकाना या भंडारण करना अस्वीकार्य है। जिंक विषाक्तता तांबे की विषाक्तता के समान है, लेकिन अधिक स्पष्ट है और मुंह और पेट में जलन और दर्द, उल्टी, दस्त और हृदय की कमजोरी के साथ होती है। जिंक के बर्तनों को केवल ठंडे पेयजल के भंडारण के लिए अनुमति दी जाती है, क्योंकि इस मामले में जिंक की घुलनशीलता नगण्य होती है।
एक वयस्क के लिए जिंक की दैनिक आवश्यकता 10-15 मिलीग्राम है। वृद्धि और यौवन के दौरान जिंक की बढ़ी हुई आवश्यकता देखी जाती है। सामान्य आहार से व्यक्ति को भोजन से पर्याप्त मात्रा में जिंक प्राप्त होता है।
पशु और पौधों के उत्पादों में सीसा बहुत कम मात्रा में पाया जाता है। तो, सेब, नाशपाती, अंगूर, स्ट्रॉबेरी में सीसा सामग्री लगभग 0.1 मिलीग्राम प्रति 1 किलोग्राम उत्पाद, दूध में - 0.8, मांस में - 0.05, स्टर्जन में - 0.06 मिलीग्राम प्रति 1 किलोग्राम है।
सीसा मनुष्यों के लिए एक जहरीली धातु है, इसमें शरीर में, मुख्य रूप से यकृत में जमा होने और गंभीर पुरानी विषाक्तता पैदा करने की क्षमता होती है।
भोजन के साथ 2-4 मिलीग्राम सीसे के दैनिक उपयोग से कुछ महीनों के बाद सीसा विषाक्तता का संकेत पता चल सकता है।
41 सीसे से खाद्य संदूषण बर्तन, सोल्डर, ग्लेज़, उपकरण और सीसा युक्त कीटनाशकों से हो सकता है। अक्सर, सीसा विषाक्तता तब होती है जब भोजन को कारीगर मिट्टी के बर्तनों में संग्रहित किया जाता है जो सीसे के शीशे से अच्छी तरह से ढके नहीं होते हैं।
उच्च विषाक्तता के कारण, खाद्य उत्पादों में सीसे की मात्रा की अनुमति नहीं है।
खाद्य उत्पादों में टिन कम मात्रा में पाया जाता है। इस प्रकार, एक बैल और एक मेढ़े के जिगर में 0.14 मिलीग्राम/किग्रा, गुर्दे में 0.003, फेफड़ों में 0.63 और मस्तिष्क में 0.019 मिलीग्राम/किग्रा टिन पाया गया।
टिन सीसा, जस्ता या तांबे जैसी जहरीली धातु नहीं है, इसलिए इसे खाद्य उद्यमों के उपकरणों में सीमित मात्रा में अनुमति दी जाती है, साथ ही टिन की सतह को टिन करने के लिए, जिससे टिन के डिब्बे तैयार किए जाते हैं, इसे जंग से बचाया जाता है। हालाँकि, अक्सर डिब्बे में डिब्बाबंद भोजन के दीर्घकालिक भंडारण के दौरान, उत्पाद का द्रव्यमान टिन की टिन कोटिंग के साथ परस्पर क्रिया करता है, जिसके परिणामस्वरूप कार्बनिक अम्लों के टिन लवण बनते हैं। यह प्रक्रिया विशेष रूप से तब सक्रिय होती है जब डिब्बे में उच्च अम्लता वाले उत्पाद होते हैं - फल, डिब्बाबंद मछली और टमाटर सॉस में सब्जियां आदि। लंबी अवधि के भंडारण के दौरान, डिब्बाबंद भोजन में टिन की मात्रा काफी बढ़ सकती है। टिन की मात्रा विशेष रूप से उन उत्पादों में तेजी से बढ़ती है जो टिन से लेपित खुले धातु के डिब्बों में होते हैं।
जंग से टिन के डिब्बे की सुरक्षा बढ़ाने के लिए, टिन की सतह पर विशेष एसिड-प्रतिरोधी वार्निश या इनेमल अतिरिक्त रूप से लगाए जाते हैं, या टिन की सतह पर स्थिर टिन ऑक्साइड की एक पतली फिल्म बनाई जाती है।
मैंगनीज पशु और वनस्पति उत्पादों में व्यापक रूप से वितरित किया जाता है। यह कई एंजाइमों के निर्माण, हड्डियों के निर्माण, हेमटोपोइजिस प्रक्रियाओं में सक्रिय भाग लेता है और विकास को उत्तेजित करता है। पौधों में, मैंगनीज प्रकाश संश्लेषण की प्रक्रिया और एस्कॉर्बिक एसिड के निर्माण को बढ़ाता है।
अधिकांश मामलों में पादप उत्पादों में पशु उत्पादों की तुलना में मैंगनीज की मात्रा अधिक होती है। तो, अनाज उत्पादों में मैंगनीज की मात्रा पत्ती में 1-15 मिलीग्राम प्रति 1 किलोग्राम तक पहुंच जाती है
सब्जियाँ - 10-20, फलों में - 0.5-1, दूध में - 0.02-0.03, अंडे में - 0.1-0.2, जानवरों के जिगर में - 2.65-2.98 मिलीग्राम प्रति 1 किलो।
मिट्टी में मैंगनीज की कमी से पौधे बीमार हो जाते हैं और खराब विकास करते हैं, फलों, सब्जियों और अन्य फसलों की उपज कम हो जाती है। मिट्टी में मैंगनीज युक्त सूक्ष्म उर्वरक मिलाने से उपज बढ़ाने में मदद मिलती है।
एक वयस्क की मैंगनीज की दैनिक आवश्यकता 5-10 मिलीग्राम प्रतिदिन है।
रेडियोधर्मी आइसोटोप मानव शरीर में मौजूद होते हैं, वे लगातार शरीर में प्रवेश करते हैं और बाहर निकलते रहते हैं। शरीर में रेडियोधर्मी यौगिकों के प्रवेश और शरीर से उनके निष्कासन के बीच एक संतुलन होता है। सभी खाद्य उत्पादों में पोटेशियम (K40), कार्बन (C14), हाइड्रोजन (H3), और इसके क्षय उत्पादों के साथ रेडियम के रेडियोधर्मी आइसोटोप होते हैं।
उच्चतम सांद्रता पोटैशियम (K40) पर पड़ती है। आइसोटोप गैर-रेडियोधर्मी आइसोटोप के साथ चयापचय में भाग लेते हैं।
ऐसा माना जाता है कि निकटतम भूवैज्ञानिक समय के दौरान पृथ्वी पर विकिरण की तीव्रता में कोई बड़ा परिवर्तन नहीं हुआ था, इसलिए, जानवरों और पौधों के साम्राज्य में विकिरण के इन स्तरों के प्रति एक प्रकार की प्रतिरक्षा विकसित हुई। लेकिन जीवित जीव उच्च सांद्रता के प्रति बहुत संवेदनशील होते हैं। छोटी सांद्रता जीवित जीवों की वृद्धि को बढ़ाती है, बड़ी सांद्रता सक्रिय कणों की उपस्थिति का कारण बनती है, जिसके परिणामस्वरूप व्यक्तिगत अंगों और ऊतकों, साथ ही पूरे जीव की महत्वपूर्ण गतिविधि का उल्लंघन होता है।
परमाणु विस्फोटों से पृथ्वी की सतह पर रेडियोधर्मी आइसोटोप निकलते हैं, जो वायुमंडल, पानी, मिट्टी और पौधों को प्रदूषित करते हैं। भोजन, वातावरण और पानी के माध्यम से रेडियोधर्मी आइसोटोप मानव शरीर में प्रवेश करते हैं।
यह स्थापित किया गया है कि जब खाद्य उत्पादों को रेडियोधर्मी आइसोटोप के विकिरण से उपचारित किया जाता है, तो उनकी शेल्फ लाइफ बढ़ जाती है, और आलू के अंकुरण में देरी होती है। लेकिन आमतौर पर, विकिरणित भोजन में एक विशिष्ट गंध और स्वाद विकसित हो सकता है, और यह संभव है कि विषाक्त पदार्थ बन सकते हैं। ऐसे उत्पादों की सुरक्षा निर्धारित करने के लिए दीर्घकालिक प्रयोगों की आवश्यकता होती है।
प्रश्नों पर नियंत्रण रखें
मैक्रोन्यूट्रिएंट्स कौन से रासायनिक तत्व हैं?
मानव शरीर में खनिजों के क्या कार्य हैं?
मानव शरीर में कैल्शियम की क्या भूमिका है?
कौन से रासायनिक तत्वों को ट्रेस तत्वों के रूप में वर्गीकृत किया गया है और मानव शरीर में उनके कार्य क्या हैं?
मानव शरीर में आयरन की क्या भूमिका है और यह किन खाद्य पदार्थों में पाया जाता है?
शरीर में आयोडीन की कमी के क्या परिणाम होते हैं और इससे कैसे बचा जा सकता है?
कच्चे माल और खाद्य उत्पादों का किस प्रकार का तकनीकी प्रसंस्करण खनिजों के नुकसान में योगदान देता है?
कुछ सूक्ष्म तत्वों और विटामिनों की परस्पर क्रिया के उदाहरण दीजिए।
आप मैक्रो- और माइक्रोलेमेंट्स की सामग्री निर्धारित करने की कौन सी विधियाँ जानते हैं?
कुकुश्किन सन प्रजनन करता है: ज़ोस्पोरेस द्वारा;
प्रतिकूल परिस्थितियों में बीज;
विवाद; +
aplanospores
- स्ट्रॉबेरी के पत्ते:
अयुग्मित पिननेट;
त्रिगुट; +
टर्नरी, एकल पत्ती;
जटिल यूनिफ़ोलिया. श्रमिक मधुमक्खियाँ हैं:
अलैंगिक व्यक्ति;
अविकसित प्रजनन अंगों वाली महिलाएं; +
अविकसित प्रजनन अंगों वाले पुरुष;
सामान्य रूप से विकसित प्रजनन अंगों वाले नर और मादा, लेकिन अस्थायी रूप से प्रजनन नहीं कर रहे हैं। मूंगा पॉलीप्स में पाचन:
केवल गुहा;
केवल अंतःकोशिकीय;
उदर और अंतःकोशिकीय; +
गुहा, अंतःकोशिकीय और बाह्य। टेरोपॉड मोलस्क जिनमें अंधेरे में चमकने की क्षमता होती है, वे इसका हिस्सा हो सकते हैं:
बेन्थोस;
न्यूस्टन;
फाइटोप्लांकटन;
ज़ोप्लांकटन। + ब्लोफ्लाई विकास चक्र का वर्णन सबसे पहले किसके द्वारा किया गया था:
एंटोन लेवेनगुक;
फ्रांसेस्को रेडी; +
हेनरी फैबरे;
लुई पास्चर। तितली कैटरपिलर में है:
पेक्टोरल पैरों के तीन जोड़े;
तीन जोड़ी वक्षीय टाँगें और पाँच जोड़ी उदर झूठी टाँगें; +
नकली पैरों के आठ जोड़े;
अंग गायब हैं. लैंसलेट की परिसंचरण प्रणाली:
खुला;
बंद, रक्त परिसंचरण का एक चक्र है; +
बंद, रक्त परिसंचरण के दो वृत्त हैं;
अनुपस्थित। सही वाक्य चुनें:
- सही वाक्य चुनें:
- साइक्लोस्टोम में, पाचन तंत्र में होता है:
एक सीधी ट्यूब का आकार;
यकृत वृद्धि;
पाइलोरिक वृद्धि;
सर्पिल वाल्व. + स्टर्जन क्रम की मछली से क्या नहीं हैगुज़रता हुआ दृश्य:
बेलुगा;
तारकीय स्टर्जन;
स्टेरलेट; +
स्टर्जन. कशेरुकियों के विकास के दौरान लार ग्रंथियाँ सबसे पहले दिखाई देती हैं:
फेफड़े की मछली;
उभयचर; +
सरीसृप;
स्तनधारी कॉड वर्ग की मछलियों में से, यह केवल ताजे जल निकायों में रहती है और अंडे देती है:
कॉड;
हैडॉक;
बरबोट; +
पोलक. चार पैरों वाले कशेरुकियों की स्वतंत्र अग्रपाद विशेषता से पक्षी के पंख की उत्पत्ति को चूजों के उदाहरण से स्पष्ट रूप से दर्शाया गया है:
शुतुरमुर्ग;
कीवी;
hoatzin; +
पेंगुइन. उड़ान में एक पक्षी के वायुगतिकीय गुणों पर प्रभावित न करेंपंख:
उड़नखटोले;
कोमल; +
संचालन;
समोच्च. पक्षियों में, त्रिविम दृष्टि निम्नलिखित प्रजातियों में सबसे अधिक विकसित होती है:
कीटभक्षी;
दानेदार;
मांसाहारी; +
प्लवकभक्षी
पशु कोशिकाओं का ग्लाइकोकैलिक्स बनता है:
प्रोटीन और लिपिड;
प्रोटीन और न्यूक्लियोटाइड;
प्रोटीन और कार्बोहाइड्रेट; +
कार्बोहाइड्रेट और न्यूक्लियोटाइड।
वह प्रक्रिया जिसके द्वारा पेचिश अमीबा लाल रक्त कोशिकाओं को निगल लेता है:
परासरण;
पिनोसाइटोसिस;
फागोसाइटोसिस; +
सुविधा विसरण।
पाइथेन्थ्रोपस अवशेष पहली बार खोजे गए थे:
दक्षिण अफ्रीका;
ऑस्ट्रेलिया;
मध्य एशिया;
दक्षिण - पूर्व एशिया। +
मनुष्य के नामित जीवाश्म पूर्वजों में सबसे प्राचीन है:
निएंडरथल;
पाइथेन्थ्रोपस;
आस्ट्रेलोपिथेकस; +
क्रो-मैग्नन।
प्रोकैरियोट्स और यूकेरियोट्स दोनों की कोशिकाओं में पाए जाने वाले अंगक:
अन्तः प्रदव्ययी जलिका;
माइटोकॉन्ड्रिया;
लाइसोसोम;
राइबोसोम. +
यूकेरियोटिक परमाणु क्रोमैटिन के मुख्य घटक हैं:
डीएनए और आरएनए;
आरएनए और प्रोटीन;
डीएनए और प्रोटीन; +
डीएनए और लिपिड. सूक्ष्मनलिकाएं प्रदान न करें:
कोशिका के आकार को बनाए रखना;
कोशिका के आकार में परिवर्तन; +
ऑर्गेनेल की गति;
कोशिका विभाजन के दौरान गुणसूत्रों की गति। स्राव के लिए नियत सेलुलर प्रोटीन को क्रमबद्ध और पैक किया जाता है:
लाइसोसोम;
एंडोसोम्स;
अन्तः प्रदव्ययी जलिका;
ट्रांस गोल्गी नेटवर्क। +
माइटोकॉन्ड्रिया में एटीपी सिंथेटेज़ एंजाइम का स्थान है:
आव्यूह;
इनतेरमेम्ब्रेन स्पेस;
बाहरी झिल्ली;
भीतरी झिल्ली। +
माइटोकॉन्ड्रिया में कार्बनिक यौगिकों का CO2 में ऑक्सीकरण होता है:
मैट्रिक्स में; +
इंटरमब्रेनर स्पेस में;
बाहरी झिल्ली पर;
भीतरी झिल्ली पर.
एंटिकोडन में शामिल हैं:
एक न्यूक्लियोटाइड;
दो न्यूक्लियोटाइड;
तीन न्यूक्लियोटाइड; +
चार न्यूक्लियोटाइड.
कोशिकीय श्वसन में अंतिम इलेक्ट्रॉन स्वीकर्ता है:
NADH;
पानी;
ऑक्सीजन; +
एटीपी.
आनुवंशिक कोड का एक गुण जो आनुवंशिक जानकारी के भंडारण और प्रसारण की विश्वसनीयता को बढ़ाता है:
त्रिक;
सार्वभौमिकता;
अतिरेक; +
विराम चिन्हों का अभाव.
मैग्नीशियम आयन इसका हिस्सा हैं:
हीमोग्लोबिन;
इंसुलिन;
क्लोरोफिल; +
थायरोक्सिन। उत्प्रेरक गतिविधि प्रदर्शित करने में सक्षम आरएनए अणुओं को कहा जाता है:
राइबोन्यूक्लिअस;
राइबोसोम;
राइबोजाइम; +
राइबोन्यूक्लियोटाइड्स। मैक्रोएर्जिक यौगिकों को कहा जाता है:
उच्च ऊर्जा वाले सहसंयोजक बंधों की उपस्थिति की विशेषता;
कुछ बंधनों के विनाश में जिसमें बड़ी मात्रा में मुक्त ऊर्जा निकलती है; +
जिसका संश्लेषण बड़ी मात्रा में ऊर्जा के व्यय से होता है;
जो जलने पर बहुत अधिक गर्मी छोड़ते हैं।
प्रकाश संश्लेषण की प्रक्रिया में उप-उत्पाद के रूप में ऑक्सीजन का स्रोत है:
रिबुलोज बिस्फोस्फेट;
ग्लूकोज;
पानी; +
कार्बन डाईऑक्साइड।
नाइट्रिफाइंग बैक्टीरिया के विकास से होता है:
पर्यावरण का अम्लीकरण; +
पर्यावरण का क्षारीकरण;
पर्यावरण का निष्प्रभावीकरण;
माध्यम के pH को प्रभावित नहीं करता.
दूध के किण्वन के परिणामस्वरूप एसिडोफिलस बनता है:
लैक्टिक एसिड बैक्टीरिया; +
यीस्ट;
लैक्टिक एसिड बैक्टीरिया और खमीर की मिश्रित संस्कृति;
लैक्टिक एसिड और प्रोपियोनिक एसिड बैक्टीरिया की मिश्रित संस्कृति।
इन बीमारियों में से, यह एक वायरस के कारण होता है:
हैज़ा;
चेचक; +
प्लेग;
मलेरिया.
पादप कोशिका घटकों में से, तम्बाकू मोज़ेक वायरस संक्रमित करता है:
माइटोकॉन्ड्रिया;
क्लोरोप्लास्ट; +
मुख्य;
रसधानियाँ