Joni magnezija su dio hemoglobina inzulina. Starosne promjene u mineralnim i organskim komponentama koštanog tkiva. Kada se trudnici prepisuju preparati magnezijuma. Magnezijum i njegovo raznoliko djelovanje Magnezijum je dio čega
Nauka koja proučava ove elemente je hemija. Periodni sistem, na osnovu kojeg možete proučavati ovu nauku, pokazuje nam da postoji dvanaest protona i neutrona sadržanih u atomu magnezijuma. To se može odrediti serijskim brojem (jednak je broju protona, a bit će isti broj elektrona ako se radi o neutralnom atomu, a ne o jonu).
Hemijska svojstva magnezijuma također se proučavaju hemijom. Periodični sistem je takođe neophodan za njihovo razmatranje, jer nam pokazuje valenciju elementa (u ovom slučaju je jednaka dva). Zavisi od grupe kojoj atom pripada. Osim toga, uz njegovu pomoć možete saznati da je molarna masa magnezija dvadeset četiri. To jest, jedan mol ovog metala teži dvadeset četiri grama. Formula magnezijuma je vrlo jednostavna - ne sastoji se od molekula, već od atoma ujedinjenih kristalnom rešetkom.
Karakteristike magnezijuma u pogledu fizike
Kao i svi metali osim žive, ovo jedinjenje ima čvrsto stanje agregacije u normalnim uslovima. Ima svijetlo sive boje sa posebnim sjajem. Ovaj metal ima prilično visoku čvrstoću. Fizičke karakteristike magnezijuma se tu ne završavaju.
Uzmite u obzir tačke topljenja i ključanja. Prvi je jednak šest stotina i pedeset stepeni Celzijusa, drugi hiljadu devedeset stepeni Celzijusa. Može se zaključiti da se radi o metalu prilično niskog topljenja. Osim toga, vrlo je lagan: njegova gustina je 1,7 g/cm3.
Magnezijum. hemija
Poznavajući fizičke karakteristike ove tvari, možemo prijeći na drugi dio njenih karakteristika. Ovaj metal ima prosječan nivo aktivnosti. To se može vidjeti iz elektrohemijskog niza metala – što je pasivniji, to je više udesno. Magnezijum je jedan od prvih na lijevoj strani. Razmotrite, redom, sa kojim supstancama reaguje i kako se to dešava.
Sa jednostavnim
To uključuje one čiji se molekuli sastoje od samo jednog hemijskog elementa. Ovo je kiseonik, i fisfor, i sumpor, i mnogi drugi. Razmotrimo prvo interakciju s kisikom. To se zove sagorevanje. U tom slučaju nastaje oksid ovog metala. Ako sagorite dva mola magnezijuma, a potrošite jedan mol kiseonika, dobijamo dva mola oksida. Jednačina za ovu reakciju je napisana na sljedeći način: 2Mg + O 2 = 2MgO. Osim toga, kada se magnezij sagorijeva na otvorenom, nastaje i njegov nitrid, jer ovaj metal reagira paralelno sa dušikom sadržanim u atmosferi.
Prilikom sagorevanja tri mola magnezijuma troši se jedan mol azota, a kao rezultat dobijamo jedan mol nitrida dotičnog metala. Jednačina ove vrste hemijske interakcije može se napisati na sledeći način: 3Mg + N 2 = Mg 3 N 2.

Osim toga, magnezij je u stanju reagirati s drugim jednostavnim tvarima kao što su halogeni. Do interakcije s njima dolazi samo kada se komponente zagriju na vrlo visoke temperature. U tom slučaju dolazi do reakcije adicije. Halogeni uključuju takve jednostavne tvari: hlor, jod, brom, fluor. Reakcije se u skladu s tim nazivaju: hloriranje, jodiranje, bromiranje, fluoriranje. Kao što ste mogli pretpostaviti, kao rezultat takvih interakcija možete dobiti hlorid, jodid, bromid, magnezijum fluorid. Na primjer, ako uzmemo jedan mol magnezija i istu količinu joda, dobićemo jedan mol jodida ovog metala. Ova hemijska reakcija se može izraziti pomoću sledeće jednačine: Mg + I 2 = MgI 2. Isti princip važi i za hlorisanje. Evo jednačine reakcije: Mg + Cl 2 = MgCl 2.
Osim toga, metali, uključujući magnezij, reagiraju s fosforom i sumporom. U prvom slučaju možete dobiti fosfid, u drugom - sulfid (ne brkati se sa fosfatima i sulfatima!). Ako uzmete tri mola magnezijuma, dodate mu dva mola fosfora i zagrejete na željenu temperaturu, formira se jedan mol fosfida dotičnog metala. Jednačina za ovu hemijsku reakciju je sljedeća: 3Mg + 2P = Mg 3 P 2. Slično, ako pomiješamo magnezij i sumpor u istim molarnim omjerima i stvorimo potrebne uvjete u vidu visoke temperature, dobijemo sulfid ovog metala. Jednačina za takvu hemijsku interakciju može se napisati na sledeći način: Mg + S = MgS. Tako smo ispitali reakcije ovog metala sa drugim jednostavnim supstancama. Ali hemijska karakterizacija magnezijuma se tu ne završava.
Reakcije sa kompleksnim jedinjenjima
Ove supstance uključuju vodu, soli, kiseline. Metali različito reaguju s različitim grupama. Razmotrimo sve po redu.
Magnezijum i voda
Kada ovaj metal stupi u interakciju s najčešćim kemijskim spojem na Zemlji, nastaju oksid i vodonik u obliku plina oštrog neugodnog mirisa. Da bi se izvela ovakva reakcija, komponente se također moraju zagrijati. Ako pomešate jedan mol magnezijuma i vode, dobijate istu količinu oksida i vodonika. Jednačina reakcije je napisana na sljedeći način: Mg + H 2 O \u003d MgO + H 2.
Interakcija sa kiselinama
Kao i drugi reaktivni metali, magnezijum je u stanju da istisne atome vodika iz svojih jedinjenja. Takvi procesi se nazivaju. U takvim slučajevima atomi metala zamjenjuju atome vodika i formiraju sol koja se sastoji od magnezija (ili nekog drugog elementa) i kiselog taloga. Na primjer, ako uzmete jedan mol magnezija i dodate ga u količini od dva mola, formira se jedan mol hlorida dotičnog metala i ista količina vodika. Jednačina reakcije će izgledati ovako: Mg + 2HCl = MgCl 2 + H 2.
Interakcija soli
Već smo opisali kako nastaju soli iz kiselina, ali karakterizacija magnezija sa stanovišta hemije podrazumijeva i razmatranje njegovih reakcija sa solima. U ovom slučaju, interakcija se može dogoditi samo ako je metal koji je dio soli manje aktivan od magnezija. Na primjer, ako uzmemo po jedan mol magnezijuma i bakar sulfata, dobićemo sulfat dotičnog metala i čisti bakar u jednakom molarnom odnosu. Jednačina za ovu vrstu reakcije može se napisati na sljedeći način: Mg + CuSO 4 = MgSO 4 + Cu. Tu dolazi do izražaja redukciona svojstva magnezijuma.

Primena ovog metala
Zbog činjenice da je u mnogim aspektima superiorniji od aluminija - otprilike je tri puta lakši, ali u isto vrijeme dvostruko jači, postao je raširen u raznim industrijama. Prije svega, ovo je industrija aviona. Ovdje legure na bazi magnezija zauzimaju prvo mjesto po popularnosti među svim korištenim materijalima. Osim toga, koristi se u hemijskoj industriji kao redukciono sredstvo za ekstrakciju određenih metala iz njihovih spojeva. Zbog činjenice da pri sagorijevanju magnezij stvara vrlo moćan bljesak, koristi se u vojnoj industriji za proizvodnju signalnih raketa, municije sa blic-šumom itd.
Dobijanje magnezijuma
Glavna sirovina za to je hlorid dotičnog metala. To se radi elektrolizom.
Kvalitativna reakcija na katione datog metala
Ovo je posebna procedura dizajnirana za određivanje prisustva jona neke supstance. Za ispitivanje prisustva magnezijevih spojeva u otopinu se može dodati kalijum ili natrijum karbonat. Kao rezultat, formira se bijeli talog, koji je lako topljiv u kiselinama.
Gdje se ovaj metal može naći u prirodi?
Ovaj hemijski element je prilično čest u prirodi. Zemljina kora je skoro dva posto sastavljena od ovog metala. Nalazi se u sastavu mnogih minerala, kao što su karnalit, magnezit, dolomit, talk, azbest. Formula prvog minerala izgleda ovako: KCl.MgCl 2 .6H 2 O. Izgleda kao kristali plavičaste, blijedo ružičaste, izblijedjele crvene, svijetlo žute ili providne.

Magnezit je njegova hemijska formula - MgCO 3 . Bijele je boje, ali u zavisnosti od nečistoća može imati sivu, smeđu ili žutu nijansu. Dolomit ima sledeću hemijsku formulu: MgCO 3 .CaCO 3 . To je žućkasto-sivi ili staklasti mineral.
Talk i azbest imaju složenije formule: 3MgO.4SiO 2 .H 2 O i 3MgO.2SiO 2 .2H 2 O, respektivno. Zbog svoje visoke otpornosti na toplinu, široko se koriste u industriji. Osim toga, magnezijum je uključen u hemijski sastav ćelije i strukturu mnogih organskih supstanci. Ovo ćemo detaljnije razmotriti.
Uloga magnezijuma u organizmu
Ovaj hemijski element je važan i za biljna i za životinjska stvorenja. Magnezijum je vitalan za biljni organizam. Kao što je gvožđe osnova hemoglobina, neophodnog za život životinja, tako je i magnezijum glavni sastojak hlorofila, bez kojeg biljka ne može da postoji. Ovaj pigment je uključen u proces fotosinteze, u kojoj se hranjive tvari sintetiziraju iz neorganskih spojeva u listovima.

Magnezijum je takođe veoma potreban organizmu životinja. Maseni udio ovog elementa u tragovima u ćeliji je 0,02-0,03%. Unatoč činjenici da je tako mali, obavlja vrlo važne funkcije. Zahvaljujući njemu, održava se struktura takvih organela kao što su mitohondrije, koje su odgovorne za ćelijsko disanje i sintezu energije, kao i ribozomi, u kojima se formiraju proteini neophodni za život. Osim toga, uključen je u hemijski sastav mnogih enzima koji su potrebni za unutarćelijski metabolizam i sintezu DNK.
Za tijelo u cjelini magnezijum je neophodan za učešće u metabolizmu glukoze, masti i nekih aminokiselina. Također, uz pomoć ovog mikroelementa može se prenijeti nervni signal. Uz sve navedeno, dovoljna količina magnezijuma u organizmu smanjuje rizik od srčanih, srčanih i moždanih udara.
Simptomi visokog i niskog nivoa u ljudskom tijelu
Nedostatak magnezija u organizmu manifestuje se takvim glavnim simptomima kao što su visok krvni pritisak, umor i loša radna snaga, razdražljivost i loš san, oštećenje pamćenja i česte vrtoglavice. Mogu se primijetiti i mučnina, konvulzije, drhtanje u prstima, zbunjenost svijesti - to su znaci vrlo niskog nivoa unosa ovog mikroelementa hranom.

Nedostatak magnezijuma u organizmu dovodi do čestih respiratornih oboljenja, poremećaja u kardiovaskularnom sistemu, kao i dijabetesa tipa 2. Zatim razmotrite sadržaj magnezijuma u hrani. Da biste izbjegli njegov nedostatak, morate znati koja je hrana bogata ovim hemijskim elementom. Također treba uzeti u obzir da se mnogi od ovih simptoma mogu manifestirati i u suprotnom slučaju – višak magnezija u tijelu, kao i nedostatak elemenata u tragovima poput kalija i natrijuma. Stoga je važno pažljivo pregledati svoju prehranu i razumjeti suštinu problema, najbolje je to učiniti uz pomoć nutricioniste.
Kao što je već spomenuto, ovaj element je glavna komponenta hlorofila. Dakle, možete pretpostaviti da ga ima u velikoj količini u zelenilu: to su celer, kopar, peršun, karfiol i beli kupus, zelena salata i dr. . Osim toga, orašasti plodovi su bogati ovim elementom u tragovima: to su indijski orasi, orasi, kikiriki, lješnjaci i bademi. Takođe, velika količina dotičnog metala nalazi se u mahunarkama kao što su pasulj i grašak.

Mnogo toga sadrži i sastav algi, na primjer, u morskim algama. Ako se ovi proizvodi koriste u normalnim količinama, vašem tijelu neće nedostajati metala o kojem se govori u ovom članku. Ako nemate priliku redovno jesti gore navedenu hranu, onda je najbolje kupiti dodatke prehrani koji sadrže ovaj element u tragovima. Međutim, prije nego što to učinite, uvijek se trebate posavjetovati sa svojim ljekarom.
Zaključak
Magnezijum je jedan od najvažnijih metala na svetu. Našao je široku primenu u brojnim industrijama - od hemijskih do vazduhoplovnih i vojnih. Štaviše, veoma je važno sa biološke tačke gledišta. Bez toga nije moguće postojanje ni biljnih ni životinjskih organizama. Zahvaljujući ovom hemijskom elementu, odvija se proces koji daje život celoj planeti, fotosinteza.
DEFINICIJA
Magnezijum- dvanaesti element periodnog sistema. Oznaka - Mg od latinskog "magnezijum". Smješten u trećem periodu, grupa IIA. Odnosi se na metale. Nuklearni naboj je 12.
Magnezijum je veoma čest u prirodi. Javlja se u velikim količinama kao magnezijum karbonat, formirajući minerale magnezit MgCO 3 i dolomit MgCO 3 × CaCO 3 . Sulfat i magnezijum hlorid su deo minerala kainit KCl × MgSO 4 × 3H 2 O i karnalit KCl × MgCl 2 × 6H 2 O. Jon Mg 2+ se nalazi u morskoj vodi, dajući joj gorak ukus. Ukupna količina magnezijuma u zemljinoj kori iznosi oko 2% (tež.).
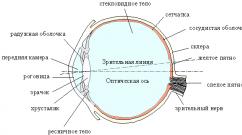
U obliku jednostavne supstance, magnezijum je srebrnobeli (slika 1), veoma lagan metal. Na zraku se malo mijenja, jer se brzo prekriva tankim slojem oksida, koji ga štiti od dalje oksidacije.
Rice. 1. Magnezijum. Izgled.
Atomska i molekulska težina magnezijuma
Relativna molekulska težina supstance (M r) je broj koji pokazuje koliko je puta masa date molekule veća od 1/12 mase atoma ugljika i relativna atomska masa elementa (Ar r) je koliko je puta prosječna masa atoma nekog kemijskog elementa veća od 1/12 mase atoma ugljika.
Budući da u slobodnom stanju magnezij postoji u obliku monoatomskih molekula Mg, vrijednosti njegove atomske i molekularne mase su iste. One su jednake 24,304.
Izotopi magnezijuma
Poznato je da se magnezijum može pojaviti u prirodi u obliku tri stabilna izotopa 24 Mg (23,99%), 25 Mg (24,99%) i 26 Mg (25,98%). Njihovi maseni brojevi su 24, 25 i 26, respektivno. Jezgro atoma izotopa magnezija 24 Mg sadrži dvanaest protona i dvanaest neutrona, a izotopi 25 Mg i 26 Mg sadrže isti broj protona, trinaest, odnosno četrnaest neutrona.
Postoje umjetni izotopi magnezija s masenim brojevima od 5 do 23 i od 27 do 40.
Magnezijum joni
Na vanjskom energetskom nivou atoma magnezija, postoje dva elektrona koji su valentni:
1s 2 2s 2 2p 6 3s 2 .
Kao rezultat hemijske interakcije, manijum odustaje od svojih valentnih elektrona, tj. je njihov donor, i pretvara se u pozitivno nabijeni ion:
Mg 0 -2e → Mg 2+.
Molekula i atom magnezija
U slobodnom stanju, magnezijum postoji u obliku monoatomskih molekula Mg. Evo nekih svojstava koja karakteriziraju atom i molekulu magnezija:
legure magnezijuma
Glavno područje primjene metalnog magnezija je proizvodnja različitih lakih legura na njegovoj osnovi. Dodavanje malih količina drugih metala magnezijumu dramatično mijenja njegova mehanička svojstva, dajući leguri značajnu tvrdoću, čvrstoću i otpornost na koroziju.
Legure koje se nazivaju elektroni imaju posebno vrijedna svojstva. Pripadaju u tri sistema: Mg-Al-Zn, Mg-Mn i Mg-Zn-Zr. Najviše se koriste legure Mg-Al-Zn sistema koje sadrže od 3 do 10% aluminijuma i od 0,2 do 3% cinka. Prednost legura magnezijuma je njihova mala gustina (oko 1,8 g/cm3).
Primjeri rješavanja problema
PRIMJER 1
Sve je počelo fotosintezom. Zanimljivo je primijetiti da su se značaj magnezija za naš organizam i posljedice njegovog nedostatka počeli procjenjivati u isto vrijeme kada su otkrivene tajne fotosinteze biljaka – prije samo nekoliko decenija.
Proces kontinuiranog formiranja organske materije započeo je prije više milijardi godina, kada su se na Zemlji pojavili pigmenti, koji su upijajući sunčevu svjetlost uzrokovali kemijske reakcije. Odlučujuću ulogu u tome imale su "fotoosjetljive" tvari iz grupe nastalih od jednostavnih spojeva - i glicerola. Međutim, tek pojavom magnezijevog derivata porfirina u obliku hlorofila počela je prirodna istorija viših oblika organskog života. Klorofil ima sposobnost da izvrši ireverzibilnu fotokemijsku reakciju, čija se energija akumulira u stabilnim biohemijskim spojevima.
Proces fotosinteze nastao je, vjerovatno, na kraju pretkambrijskog perioda (prije oko 1000 miliona godina). Struktura hlorofila je vrlo bliska strukturi hema, glavne komponente krvnog pigmenta. Razlika je u tome što hlorofil sadrži magnezijum (jon magnezijuma), a hem, hemoglobin - (jon gvožđa). Ovo otkriće profesora Jagelonskog univerziteta Leona Marklevskog potvrdilo je vezu između evolucije flore i faune.
Biljke venu kada ima malo magnezijuma u zemljištu, sporije rastu, lišće im bledi i prerano žuti. Dodavanje magnezijevih soli u tlo u potpunosti vraća biljke "".
Možemo reći da se i čovjeku dešava isto, iako je... sve je mnogo komplikovanije. Čovek ne može biti zdrav ako u hrani nema dovoljno magnezijuma. Do ovog zaključka došli su učesnici prvog Kongresa o bolestima uzrokovanim nedostatkom magnezijuma. Kongres je održan u maju 1971. godine u Vittelu. Magnezijev jon igra posebnu ulogu u gotovo svim procesima koji se odvijaju u tijelu. Dakle, u imunološkim procesima djeluje antistresno, antitoksično, antialergijsko, antianafilaktično (vrsta osjetljivosti), protuupalno, štiti od jonizujućeg zračenja, reguliše temperaturu, stimuliše i učestvuje u stvaranju antitela. Magnezijum deluje opuštajuće i smanjuje osetljivost organizma. Tada je, na kongresu u Vittelu, profesor Dürlach rekao: "Znak modernog civilizovanog svijeta je sve manji nivo jona magnezijuma."
Čini se da su civilizacijske bolesti u velikoj mjeri uzrokovane nedostatkom magnezija u ljudskom tijelu. Stoga je vrijedno detaljnije pogledati magnezij.
Magnezijum dobijamo iz zemlje - putem biljne hrane i hrane dobijene od životinja koje se hrane biljkama. Dakle, onoliko magnezijuma uđe u naše tijelo koliko je u tlu.
U međuvremenu, u zemljištu ima malo magnezijuma. Nedostatak magnezija je zabilježen u 40% poljskih zemalja, prosječan sadržaj u 34% zemalja, a dovoljan ili visok sadržaj u manje od 26%. Umjetna gnojiva ili uopće ne obogaćuju tlo magnezijem, ili ga prima premalo. Na primjer, 1971-1975. Prosječna količina magnezija dodanog poljskom zemljištu bila je 10-12 kg magnezijum oksida (MgO) po 1 ha obrađenog zemljišta. Da li je to puno ili malo? Pšenica sa prinosom od 40 q/ha treba da dobije iz zemlje oko 17 kg sa 1 ha MgO, a šećerna repa sa prinosom od samo 350 q/ha - oko 66 kg.
Naravno, potrebna količina magnezijumskog đubriva zavisi od sadržaja magnezijuma u tlu i vrste useva koji se uzgaja. Obično je od 130 do 260 kg/ha. Od ove količine kieserita (magnezijumovog đubriva) u zemljište prelazi 30-60 kg magnezijum oksida i, pored toga, 15-31 kg kalijum oksida. Stajnjak sadrži 0,18% magnezijuma, što znači da ako unesemo 300 kg stajnjaka na 1 ha dobijamo oko 54 kg Mg. Ovo definitivno nije dovoljno.
Hlorofil sadrži 2,7% magnezijuma. Joni magnezija regulišu stepen hidratacije ćelija. Sa nedostatkom magnezijuma u biljkama, proces isparavanja vode je ograničen, a sa viškom, biljka intenzivno upija vodu, tako da se zemlja suši u korenovom sistemu.
Za zainteresovane, evo tabele.
Prirodno je sredstvo za smirenje i mineral protiv stresa!
Magnezijum je jedan od najčešćih elemenata u prirodi, sastavni je sastojak kostiju i zubne cakline kod ljudi i životinja, a u biljkama je deo hlorofila. Joni magnezija se nalaze u vodi za piće, a morska voda sadrži mnogo magnezijum hlorida.
Tijelo sadrži 20-30 g magnezijuma. Otprilike 1% magnezijuma nalazi se u tjelesnim tečnostima, dok se preostalih 99% nalazi u kostima (oko 40%) i mekim tkivima (oko 59%).
Hrana bogata magnezijumom
Procijenjena dostupnost u 100 g proizvoda
Dnevna potreba za magnezijumom je 400-500 mg.
Potreba za magnezijumom se povećava sa:
- stres;
- sadržaj velike količine proteina u prehrani;
- brzo stvaranje novih tkiva - kod djece, bodibildera;
- trudnoća i dojenje;
- uzimanje diuretika.
Probavljivost
Magnezijum se apsorbuje uglavnom u duodenumu i malo u debelom crevu. Ali samo organska jedinjenja magnezijuma se dobro apsorbuju, na primer, organska jedinjenja magnezijuma u sastavu kompleksa sa aminokiselinama, organskim kiselinama (magnezijum laktat, magnezijum citrat) itd. Neorganske soli (magnezijum sulfat) se vrlo slabo apsorbuju.
Prevelik unos kalcijuma (Ca), fosfora (P), natrijuma (Na), masti u organizmu otežava apsorpciju magnezijuma. Dijetalna vlakna vezuju magnezijum, a višak alkohola, kofeina i kalijuma (K) povećavaju gubitak magnezija u urinu.
Korisna svojstva magnezijuma i njegov uticaj na organizam
Magnezijum igra značajnu ulogu u organizmu – neophodan je za normalno funkcionisanje oko 300 enzima. Zajedno sa kalcijumom (Ca) i fosforom (P), magnezijum je uključen u formiranje zdravih kostiju.
Magnezijum je neophodan za metabolizam glukoze, aminokiselina, masti, transport hranljivih materija i neophodan je za proizvodnju energije. Magnezijum je uključen u proces sinteze proteina, prenosa genetskih informacija, nervnih signala. Neophodan za održavanje zdravog kardiovaskularnog sistema. Adekvatan nivo magnezijuma smanjuje verovatnoću srčanog udara.
Magnezijum normalizuje mišićnu aktivnost, snižava holesterol, pomaže u čišćenju organizma od određenih vrsta toksičnih supstanci.
Magnezijum zajedno sa vitaminom B6 (piridoksinom) sprečava nastanak kamena u bubregu. Ako nedostaje samo magnezijuma, bubrežni kamenci su najčešće fosfatni (spoji kalcijuma sa fosforom), a ako nedostaje samo vitamin B6, pojavljuju se oksalatni kamenci (spoji kalcijuma (Ca) sa oksalnom kiselinom).
On je poznat kao antistresna supstanca- Dodatna količina magnezijuma doprinosi povećanju otpornosti na stres. Magnezijumove soli inhibiraju rast malignih tumora.
Magnezijum pomaže i u borbi protiv prekomernog rada – preporučuje se upotreba suplemenata koji sadrže magnezijum kod hroničnog preopterećenja.
Interakcija sa drugim bitnim elementima
Magnezijum zajedno sa natrijumom (Na) i fosforom (P) učestvuje u mišićnoj i nervnoj aktivnosti organizma. Vitamin D reguliše metabolizam magnezijuma, čime se povećava efikasnost njegovog delovanja. Vitamin E, vitamin B6 i kalijum (K) takođe poboljšavaju metabolizam magnezijuma. Sa nedostatkom magnezijuma, kalijum (K) se ne zadržava unutar ćelija.
U ljudskom organizmu kalcijum i magnezijum moraju biti u određenom međusobnom odnosu. Smatra se da ovaj omjer ne bi trebao biti veći od 1:0,6. Dakle, s nedostatkom magnezija, kalcij će se izgubiti u urinu, a višak kalcija, zauzvrat, uzrokuje nedostatak magnezija.
Nedostatak i višak magnezijuma
Znakovi nedostatka magnezijuma
- nesanica, jutarnji umor (čak i nakon dugog sna);
- razdražljivost, povećana osjetljivost na buku, nezadovoljstvo;
- vrtoglavica, gubitak ravnoteže;
- pojava treperavih tačaka pred očima;
- promjene krvnog tlaka, nepravilan rad srca;
- mišićni grčevi, grčevi, trzaji;
- grčeviti bol u želucu, praćen proljevom;
- gubitak kose, lomljivi nokti;
- česte glavobolje.
Znakovi viška magnezijuma
- pospanost, poremećena koordinacija, govor;
- letargija;
- usporen rad srca;
- mučnina, povraćanje, dijareja;
- suhe sluzokože (posebno usne šupljine).
Visok nivo magnezijuma u krvi (hipermagneziemija) je uzrokovan prekomernim unosom preparata magnezijuma, bez kompenzacije suplementima kalcijuma (Ca).
Faktori koji utiču na sadržaj magnezijuma u hrani
Moderne metode prerade hrane smanjuju sadržaj magnezija. Čak i iz namirnica bogatih magnezijumom, gubi se ako se namirnice namače u vodi, ali se dekocije i infuzije ne koriste za hranu.
Mineralni elementi.doc
Minerali1. Uloga mineralnih elemenata u ljudskom tijelu 1
2. Makronutrijenti, njihove karakteristike
3. Elementi u tragovima, njihove karakteristike
4. Utjecaj tehnološke obrade
O mineralnom sastavu prehrambenih proizvoda
5. Metode za određivanje mineralnih materija
1. Uloga mineralnih elemenata u ljudskom tijelu
Mnogi elementi u obliku mineralnih soli, jona, složenih spojeva i organskih supstanci dio su žive tvari i esencijalni su nutrijenti koji se svakodnevno moraju unositi hranom. Sadržaj minerala u glavnim namirnicama dat je u tabeli. 5.1.
Kako odrediti nedostatak magnezijuma u organizmu?
Prvi znak esencijalnih metala je poništavanje simptoma i vraćanje optimalnog rasta goveda. S vremenom su biohemijske studije dovele do izolacije enzima koji su zahtijevali funkcionisanje metalnih jona, a ubrzo nakon toga, ovi specifični enzimi mogli su biti povezani sa simptomima nedostatka.
Promjene u probavnom sistemu
Interakcije metalnih jona su smatrane štetnim i vrednim za sistem. Na primjer, jedna rana studija je pokazala da bakar pojačava efekte željeza u ublažavanju anemije kod laboratorijskih pacova hranjenih ishranom zasnovanom na mlijeku; ovo zapažanje je ponovljeno kod pilića i svinja i ubrzo je privuklo pažnju kliničara koji su usvojili sličan bimetalni protokol za liječenje anemičnih ljudi. Uporedo s pojavom polupročišćenih dijeta u isto vrijeme, nauka o ishrani bila je na pragu važnih otkrića o ulozi esencijalnih mineralnih elemenata.
U skladu sa preporukom komisije za ishranu Nacionalne akademije nauka SAD, dnevni unos hemijskih elemenata hranom treba da bude na određenom nivou (tabela 5.2). Isti broj hemijskih elemenata mora se dnevno izlučivati iz organizma, jer je njihov sadržaj u njemu relativno konstantan.
Mineralni kofaktori sadrže veliku grupu anorganskih supstanci sa većinom metalnih jona. Domen metalnih jona uključuje makrometale, metalne jone u tragovima i metaloide. U potrazi za razlogom njihove neophodnosti, moramo shvatiti da su ioni metala pogodni za izvođenje opasnih hemijskih reakcija na enzimskim površinama, reakcija koje mogu oštetiti osjetljivije bočne lance organskih aminokiselina u enzimu. Na primjer, redoks metali kao što su željezo, mangan i bakar mogu prihvatiti elektrone u svojoj strukturi, privremeno ih zadržati, a zatim ih prenijeti na kisik da bi formirali vodu kao način za sigurno uklanjanje elektrona.
Uloga minerala u ljudskom organizmu je izuzetno raznolika, uprkos činjenici da nisu bitna komponenta ishrane. Mineralne tvari sadržane su u protoplazmi i biološkim tekućinama, igraju važnu ulogu u osiguravanju postojanosti osmotskog tlaka, što je neophodan uvjet za normalno funkcioniranje stanica i tkiva. Oni su dio složenih organskih spojeva (na primjer, hemoglobin, hormoni, enzimi), plastični su materijal za izgradnju koštanog i zubnog tkiva. U obliku jona, mineralne tvari sudjeluju u prijenosu nervnih impulsa, osiguravaju zgrušavanje krvi i druge fiziološke procese u tijelu.
U suštini, treba uzeti u obzir da metalni kofaktor proširuje repertoar dostupnih katalitičkih funkcija i da ga obavljaju enzimi. Enzimi koji zavise od metalnih jona kao kofaktora spadaju u 2 kategorije: enzimi aktivirani metalom i metaloenzimi. Kao što ime govori, enzimi aktivirani metalom su podstaknuti na veću katalitičku aktivnost prisustvom mono ili dvovalentnog metalnog jona na vanjskoj strani proteina. Metal može aktivirati supstrat, direktno vezati enzim ili doći u ravnotežu s enzimom koristeći njegov jonski naboj kako bi dobio povoljniju vezu sa supstratom ili bolje katalitičko okruženje.
Ovisno o količini minerala u ljudskom tijelu i prehrambenim proizvodima, dijele se na makro- I elementi u tragovima. Dakle, ako maseni udio elementa u tijelu prelazi 10 -2%, onda ga treba smatrati makroelementom. Udio elemenata u tragovima u tijelu je 10 -3 -10 -5%. Ako je sadržaj elementa ispod 10 -5%, smatra se ultramikroelementom. Makronutrijenti uključuju kalijum, natrijum, kalcijum, magnezijum, fosfor, hlor i sumpor. Sadrže se u količinama koje se mjere u stotinama i desetinama miligrama na 100 g tkiva ili hrane. Elementi u tragovima su dio tkiva tijela u koncentracijama izraženim u desetinkama, stotim i tisućitim dijelovima miligrama i neophodni su za njegovo normalno funkcioniranje. Elementi u tragovima se uslovno dele u dve grupe: apsolutno ili vitalne (kobalt, gvožđe, bakar, cink, mangan, jod, brom, fluor) i tzv. verovatno neophodne (aluminijum, stroncijum, molibden, selen, nikl, vanadijum i neki drugi ). Elementi u tragovima se nazivaju vitalnim ako je u njihovom nedostatku ili nedostatku normalno funkcioniranje tijela poremećeno.
Raspodjela elemenata u tragovima u tijelu ovisi o njihovim kemijskim svojstvima i vrlo je raznolika. Gvožđe je, na primer, sastavni deo hemoglobina, mioglobina i drugih respiratornih pigmenata, odnosno supstanci koje učestvuju u apsorpciji i transportu kiseonika do svih tkiva u telu; atomi bakra su uključeni u aktivni centar brojnih enzima itd.
Stoga, enzimi aktivirani metalom zahtijevaju da metal bude prisutan u višku, možda 2-10 puta većoj od koncentracije enzima. Budući da se metal ne može vezati na trajniji način, enzimi aktivirani metalom obično gube aktivnost tokom pročišćavanja.
Nasuprot tome, metalni enzimi imaju metalni kofaktor čvrsto vezan za specifičnu regiju na površini proteina. Uz nekoliko izuzetaka, metali u tragovima ulaze u sliku kao kofaktori za metalne enzime. Snažno sjedinjenje onemogućava da se ion metala izgubi dijalizom ili da se izgubi slabim disocijativnim agensima. Metalni enzimi, međutim, mogu izgubiti svoj metalni kofaktor i postati neaktivni kada se tretiraju metalnim kelatorima, koji imaju jači afinitet vezivanja od enzima i savladavaju enzimski protein pomoću jona metala.
Djelovanje mikroelemenata može biti i indirektno - kroz utjecaj na intenzitet ili prirodu metabolizma. Dakle, neki elementi u tragovima (na primjer, mangan, cink, jod) utiču na rast, a njihov nedovoljan unos hranom otežava normalan fizički razvoj djeteta. Ostali elementi u tragovima (na primjer, molibden, bakar, mangan) su uključeni u reproduktivnu funkciju, a njihov nedostatak u tijelu negativno utječe na ovu stranu ljudskog života.
Kao prostetičke grupe, metali u metaloenzimima imaju stehiometrijski omjer predstavljen punim integratorom. Metaloenzimi se rijetko pripremaju za povećanje aktivnosti dodavanjem svog konjugovanog metalnog jona enzimu. Prostorna geometrija je također zabrinjavajuća: metali u prvoj seriji tranzijenta moraju se pridržavati strogih geometrijskih konfiguracija oko mjesta spajanja metala.
Sa izuzetkom onih sa cinkom, enzimi sa metalima iz prve prolazne serije imaju tendenciju da budu veoma svetli; na primjer, crvena boja hemoglobina ili plava boja ceruloplazmina povezana s bakrom. Većina enzima kombinuje gvožđe sa gvožđem ili kao hem ili kao poseban raspored gvožđa sa sumpornim grupama, poznatim kao gvožđe-sumporni centri. Gvožđe u hemu pokazuje jak afinitet za jone magnezijuma u hlorofilu. Hem, koji je u osnovi porfirinski prstenasti sistem sa gvožđem smeštenim u centru, je najzastupljeniji oblik gvožđa u biološkim proteinima.
Najdeficitarniji minerali u ishrani savremenog čoveka su kalcijum i gvožđe, a višak natrijum i fosfor.
Nedostatak ili višak u prehrani bilo kojih mineralnih tvari uzrokuje kršenje metabolizma proteina, masti, ugljikohidrata, vitamina, što dovodi do razvoja niza bolesti. Ispod su karakteristični (tipični) simptomi nedostatka različitih hemijskih elemenata u ljudskom organizmu: Najčešća posledica neslaganja u količini kalcijuma i fosfora u ishrani je karijes zuba, stanjivanje kostiju. Nedostatkom fluora u vodi za piće dolazi do uništavanja zubne cakline, a nedostatak joda u hrani i vodi dovodi do oboljenja štitne žlijezde. Stoga su minerali veoma važni za eliminaciju i prevenciju niza bolesti.
Najčešće veze
Kao komponenta gvožđe-sumpornih centara, gvožđe ulazi u nekoliko grupnih šema sa cisteinskim ostacima u enzimima koji omogućavaju direktniji kontakt sa proteinom. Gvožđe u ovim centrima se vezuje za supstrate, kao i prenosi elektrone i učestvuje u reakcijama koje uključuju dehidraciju i preuređenje. Enzimi sa centrima željezo-sumpor uključuju ksantin oksidazu, sukcinat dehidrogenazu, akonitazu i dušičnu kiselinu.
Ovaj raspored omogućava enzimu da ukloni atom vodika iz vrlo stabilne veze C-H. Nemetal može zamijeniti željezo u ovim kompleksima. Enzimi sa hem grupom su obično crvenkasto smeđe boje. Boja je motivisala početni interes za ove proteine i bila je motivirajući faktor za označavanje hem proteina u mitohondrijima kao "citohroma".


Navodimo uzroke metaboličkih poremećaja mineralnih supstanci koji se mogu javiti i uz njihovu dovoljnu količinu u hrani:
A) neuravnotežena ishrana (nedovoljne ili prevelike količine proteina, masti, ugljenih hidrata, vitamina itd.);
Iako samo nekoliko rastvorljivih enzima ima željezo kao kofaktor, željezo je posebno istaknuto u proteinima vezanim za membranu koji sadrže puteve transporta elektrona. Svojstvo redoks gvožđa igra veliki deo njegove hemije kao kofaktora. Gvožđe je skoro uvek uključeno u prenos elektrona i često donira elektrone molekulu kiseonika.
I katalaza i peroksidaza, dva hem enzima, koriste željezo za interakciju s opasnim oksidansima. Oba enzima nalaze se u citosolu i u peroksizomima, gdje se javljaju štetne oksidacijske reakcije tijekom normalnih metaboličkih događaja. Možda najpoznatiji enzim koji sadrži željezo je citokrom c oksidaza, terminalni akceptor elektrona u mitohondrijskom lancu transporta elektrona i enzim koji je sposoban da podijeli molekul kisika u vodu.
B) korištenje metoda kulinarske obrade prehrambenih proizvoda, koje uzrokuju gubitak minerala, na primjer, prilikom odmrzavanja (u vrućoj vodi) mesa, ribe ili pri uklanjanju dekocija od povrća i voća, gdje prolaze rastvorljive soli;
C) nedostatak pravovremene korekcije sastava ishrane kada se potreba organizma za mineralima povezana sa fiziološkim razlozima menja. Tako, na primjer, kod ljudi koji rade u uvjetima visoke temperature okoline povećava se potreba za kalijem, natrijem, klorom i drugim mineralima zbog činjenice da se većina njih izlučuje iz tijela znojem;
Uloga magnezijuma u ljudskom tijelu
Cink je možda najzastupljeniji i najraznovrsniji od svih metalnih kofaktora. Više od 300 enzima ima kofaktor cinka. Otprilike 3% genoma sisara kodira proteine cinkovih prstiju. Kao kofaktor, cink može obavljati i strukturne i katalitičke funkcije. Ovi primjeri ilustruju zašto je cink važan pratilac enzima i proteina.
Cink se smatra mekim metalom jer se ponaša kao dvovalentni kation bez mnogo geometrijskih preferencija. Možda ova mekoća omogućava cinku da se prilagodi mnogim različitim okruženjima fermentacije. Iz tog razloga, kompleksi cinka su bezbojni, a sam cink se prvenstveno ponaša kao katjon. Drugi primjer je upotreba cinka za polarizaciju esterske ili amidne veze, čime se olakšava nukleofilni napad vode na spoj, kao u reakcijama kataliziranim karboksipeptidazom i aminopeptidazom.
D) kršenje procesa apsorpcije minerala u gastrointestinalnom traktu ili povećan gubitak tekućine (na primjer, gubitak krvi).
^
2. Makronutrijenti, njihove karakteristike
Kalcijum. To je glavna strukturna komponenta kostiju i zuba; dio je jezgara stanica, ćelijskih i tkivnih tečnosti, neophodan je za zgrušavanje krvi. Kalcijum formira spojeve sa proteinima, fosfolipidima, organskim kiselinama; učestvuje u regulaciji permeabilnosti ćelijskih membrana, u prenosu nervnih impulsa, u molekularnom mehanizmu mišićnih kontrakcija, kontroliše aktivnost niza enzima. Dakle, kalcijum obavlja ne samo plastične funkcije, već utječe i na mnoge biohemijske i fiziološke procese u tijelu.
Bakar je, kao i gvožđe, redoks metal. Enzimi bakra, iako nisu toliko brojni kao enzimi cinka, obavljaju važne biološke funkcije, uglavnom u citosolu. Najsloženiji enzimi uključuju multicorex oksidaze, koje mogu imati samo 4 ili čak 8 atoma bakra po enzimu. Bakar u ovim enzimima postoji u tri različita hemijska okruženja, poznata kao tip 1, tip 2 i tip bakra. Mjesto bakra tipa 1 daje plavu boju ceruloplazminima i drugim plavim proteinima s bakrom.
Vezna mjesta za bakar u polioksid oksidazi formiraju trijadu koja se sastoji od bakra tipa 3 2 i 3 bakra raspoređenih u jednakokraki trokut. Kiseonik se vezuje za ova dva leka tipa 3 u osnovi trougla. Zbog svoje sklonosti prihvatanju elektrona, bakar je moćno oksidaciono sredstvo u biološkim sistemima. Ova reakcija povezuje metabolizam željeza s bakrom i može objasniti kako nedostatak bakra u željezu sprječava prijenos željeza i uzrokuje anemiju kod ljudi. Rijetko se od bakra traži da igra samo strukturnu ulogu, a mnogi enzimi koji imaju bakar kao kofaktor koriste metal na aktivnom mjestu.
Kalcijum je teško svarljiv element. Jedinjenja kalcijuma koja ulaze u ljudski organizam sa hranom su praktično nerastvorljiva u vodi. Alkalna sredina tankog crijeva potiče stvaranje neprobavljivih spojeva kalcija, a samo djelovanje žučnih kiselina osigurava njegovu apsorpciju.
Asimilacija kalcijuma u tkivima ne zavisi samo od njegovog sadržaja u hrani, već i od njegovog odnosa sa ostalim sastojcima hrane i, pre svega, sa mastima, magnezijumom, fosforom i proteinima. Sa viškom masti dolazi do konkurencije žučnim kiselinama i značajan dio kalcijuma se izlučuje iz organizma kroz debelo crijevo. Višak magnezijuma negativno utiče na apsorpciju kalcijuma; preporučeni odnos ovih elemenata je 1:0,5. Ako količina fosfora premašuje nivo kalcija u hrani za više od 2 puta, tada se stvaraju rastvorljive soli koje se krvlju izvlače iz koštanog tkiva. Kalcijum ulazi u zidove krvnih sudova, što uzrokuje njihovu krhkost, kao i u tkiva bubrega, što može doprineti nastanku bubrežnih kamenaca. Za odrasle, preporučeni odnos kalcijuma i fosfora u hrani je 1:1,5. Poteškoće u održavanju ovog omjera nastaju zbog činjenice da je najčešće konzumirana hrana mnogo bogatija fosforom nego kalcijumom. Fitin i oksalna kiselina, sadržani u brojnim biljnim proizvodima, negativno utiču na apsorpciju kalcijuma. Ova jedinjenja formiraju nerastvorljive soli sa kalcijumom.
Istraživanja su povezala ione bakra s formiranjem arterija ili angiogenezom. Jedno od najuzbudljivijih otkrića, koje tek treba u potpunosti biti shvaćeno, je da lišavanje bakra životinji odlaže ili čak inhibira rast kancerogenih tumora. Nutritivno, to bi moglo značiti da je bakar neophodan za mikrovaskularni razvoj.
Znaš li to
Dok je cink možda najčešći prijelazni metal u enzimima, mangan je možda najrjeđi, dijelom zato što kompleksi mangana s proteinima imaju tendenciju da budu slabo stabilni i lako se disociraju. Poznati mangan metaloenzimi uključuju piruvat karboksilazu i mangan superoksid dismutazu u mitohondrijima i arginazu u ciklusu uree. Mangan takođe može da funkcioniše kao kofaktor koji aktivira metal za mnoge enzime koji zahtevaju magnezijum.
Dnevna potreba za kalcijem kod odrasle osobe je 800 mg, a kod djece i adolescenata - 1000 mg ili više.
S nedovoljnim unosom kalcija ili kršenjem njegove apsorpcije u tijelu (uz nedostatak vitamina D), razvija se stanje nedostatka kalcija. Dolazi do pojačanog izlučivanja iz kostiju i zuba. Kod odraslih se razvija osteoporoza - demineralizacija koštanog tkiva, kod djece je poremećeno formiranje skeleta, razvija se rahitis.
Karakteristike ishrane sa nedostatkom magnezijuma
Iako se mangan ne smatra redoks metalom na osnovu njegove reaktivnosti, on ipak može postojati u 6 oksidacionih stanja, od kojih tri nisu uočena u biološkim sistemima. Kobalt je u kvadratnom, ravnom rasporedu pričvršćen za prsten sličan onom kod geja, ali sa vrlo posebnim karakteristikama. Za razliku od hema, kobalt ima 2 aksijalna liganda koji su bez proteina, omogućavajući proteinskim grupama da pristupe centralnom metalu iznad i ispod ravnine.
Najbolji izvori kalcijuma su mlijeko i mliječni proizvodi, razni sirevi i svježi sir (100-1000 mg/100 g proizvoda), zeleni luk, peršun, pasulj. Značajno manje kalcijuma nalazi se u jajima, mesu, ribi, povrću, voću, bobičastom voću (20-40 mg/100 g proizvoda).
Magnezijum. Ovaj element je neophodan za aktivnost brojnih ključnih enzima. za tjelesni metabolizam. Magnezijum je uključen u održavanje normalne funkcije nervnog sistema i srčanih mišića; ima vazodilatacijski efekat; stimuliše lučenje žuči; povećava motoričku aktivnost crijeva, što pomaže u uklanjanju toksina iz tijela (uključujući kolesterol).
Zašto je nedostatak magnezijuma opasan za trudnice?
U jednom oktaedarskom kompleksu, jedan aksijalni položaj obično zauzima jedan benzimidazol, a drugi metil grupa. Uređaj je jedinstven i omogućava kobaltu da formira veze ugljik-metal s potencijalom za dvije različite reakcije. Na primjer, metil grupa se može ukloniti kao karbonijev jon držanjem oba elektrona u kobaltu, koji se zatim vraća u manje stabilan.
U pozicionim permutacijama, kobalt zadržava samo jedan elektron i formira stabilan koion 7 uz oslobađanje slobodnog radikala. Slobodni radikali su visoko reaktivni i prevazilaze energetske barijere koje drugi reaktanti mogu zadržati. Dakle, hemijska svojstva grupa za prenos kobalta, kao što su joni karbona, ili visoko reaktivni radikali sa ugljikom. Oba proizvoda su moguća i objašnjavaju potrebu za kobaltom kao kofaktorom da bi se reakcija odvijala putem mehanizma slobodnih radikala.
Apsorpciju magnezijuma ometa prisustvo fitina i višak masti i kalcijuma u hrani. Dnevne potrebe za magnezijumom nisu precizno definisane; vjeruje se, međutim, da doza od 200-300 mg/dan sprječava pojavu nedostatka (pretpostavlja se da se apsorbira oko 30% magnezijuma).
S nedostatkom magnezija, apsorpcija hrane je poremećena, rast se usporava, kalcij se taloži u zidovima krvnih žila, a razvijaju se i brojne druge patološke pojave. Kod ljudi je nedostatak jona magnezijuma, zbog prirode ishrane, krajnje malo verovatan. Međutim, veliki gubici ovog elementa mogu nastati kod dijareje; njihove posledice se osećaju ako se u organizam unose tečnosti koje ne sadrže magnezijum. Kada koncentracija magnezija u serumu padne na oko 0,1 mmol/l može se javiti sindrom nalik delirijum tremens: osoba ima polukomatozno stanje, drhtanje mišića, grčeve mišića u zglobu i stopalu, povećanu neuromišićnu ekscitabilnost kao odgovor na zvuk, mehanički i vizuelni stimulansi. Uvođenje magnezija uzrokuje brzo poboljšanje stanja.
Magnezijum je bogat uglavnom u biljnoj hrani. Velika količina sadrži pšenične mekinje, razne žitarice (40 - 200 mg / 100 g proizvoda), mahunarke, kajsije, suhe kajsije, suhe šljive. Malo magnezijuma ima u mliječnim proizvodima, mesu, ribi, tjestenini, većini povrća i voća (20 - 40 mg / 100 g).
Kalijum. Oko 90% kalijuma nalazi se unutar ćelija. On, zajedno sa drugim solima, obezbeđuje osmotski pritisak; učestvuje u prijenosu nervnih impulsa; regulacija metabolizma vode i soli; potiče uklanjanje vode, a time i toksina iz tijela; održava kiselo-baznu ravnotežu unutrašnjeg okruženja tijela; učestvuje u regulaciji aktivnosti srca i drugih organa; neophodan za funkcionisanje brojnih enzima.
Kalijum se dobro apsorbuje iz creva, a njegov višak se brzo uklanja iz organizma urinom. Dnevna potreba za kalijumom kod odrasle osobe je 2000-4000 mg. Pojačava se kod obilnog znojenja, uz upotrebu diuretika, bolesti srca i jetre. Kalijum nije deficitaran nutrijent u ishrani, a uz raznovrsnu ishranu ne dolazi do manjka kalijuma. Nedostatak kalijuma u organizmu nastaje kada je poremećena funkcija neuromišićnog i kardiovaskularnog sistema, pospanost, sniženje krvnog pritiska i srčane aritmije. U takvim slučajevima je propisana dijeta sa kalijumom.
Većina kalijuma dolazi iz biljne hrane. Njegovi bogati izvori su kajsije, suve šljive, suvo grožđe, spanać, morske alge, pasulj, grašak, krompir, ostalo povrće i voće (100 - 600 mg/100 g proizvoda). Manje kalijuma ima u pavlaci, pirinču, hlebu od vrhunskog brašna (100 - 200 mg / 100 g).
Natrijum. Natrijum se nalazi u svim tkivima i tjelesnim tečnostima. On je uključen u održavanje osmotskog pritiska u tkivnim tečnostima i krvi; u prijenosu nervnih impulsa; regulacija acido-bazne ravnoteže, metabolizma vode i soli; povećava aktivnost probavnih enzima.
Metabolizam natrijuma je opsežno proučavan zbog njegovih fizioloških svojstava i važnosti za tijelo. Ovaj hranjivi sastojak se lako apsorbira iz crijeva. Joni natrija uzrokuju oticanje koloida tkiva, što uzrokuje zadržavanje vode u tijelu i sprječava njeno oslobađanje. Ukupna količina natrijuma u ekstracelularnoj tečnosti tako određuje zapreminu ovih tečnosti. Povećanje koncentracije natrijuma u plazmi dovodi do osjećaja žeđi. U toploj klimi i pri teškom fizičkom radu dolazi do značajnog gubitka natrijuma sa znojem i potrebno je u organizam unositi so kako bi se nadoknadilo izgubljeno.
U osnovi, joni natrijuma ulaze u organizam na račun kuhinjske soli - NaCl. Prekomjernom konzumacijom natrijevog klorida pogoršava se uklanjanje krajnjih produkata metabolizma topljivih u vodi kroz bubrege, kožu i druge organe za izlučivanje. Zadržavanje vode u organizmu otežava rad kardiovaskularnog sistema, povećava krvni pritisak. Stoga je konzumacija soli kod relevantnih bolesti u ishrani ograničena. Međutim, pri radu u vrućim radnjama ili vrućim klimama povećava se količina natrijuma (u obliku obične soli) koji se unosi izvana kako bi se nadoknadio njegov gubitak znojem i smanjilo znojenje, koje opterećuje funkciju srca.
Natrijum je prirodno prisutan u svim namirnicama. Način dobijanja prehrambenih proizvoda u velikoj mjeri određuje konačni sadržaj natrijuma u njemu. Na primjer, smrznuti zeleni grašak sadrži mnogo više natrijuma od svježeg. Svježe povrće i voće sadrže manje od 10 mg/kg do 1 g/kg, za razliku od žitarica i sira koji mogu sadržavati natrijum u količinama od 10-20 g/kg.
Procjena prosječnog dnevnog unosa natrijuma iz hrane je teška jer koncentracija natrijuma u hrani uvelike varira, a osim toga, ljudi su navikli na dodavanje soli u hranu. Odrasla osoba dnevno unese do 15 g kuhinjske soli i istu količinu izluči iz organizma. Ova količina je mnogo veća od fiziološki potrebne a determinisan je prvenstveno ukusom natrijum hlorida, navikom slane hrane. Sadržaj kuhinjske soli u ljudskoj hrani može se smanjiti na 5 g dnevno bez štete po zdravlje. Na oslobađanje natrijum hlorida iz organizma, a samim tim i na potrebu za njim, utiče količina kalijevih soli koje telo prima. Biljna hrana, posebno krompir, bogata je kalijumom i povećava izlučivanje natrijum hlorida u urinu, a samim tim i povećava potrebu za njim.
Fosfor. Fosfor se nalazi u svim tkivima tijela, posebno u mišićima i mozgu. Ovaj element je uključen u sve životne procese u tijelu. : sinteza i razgradnja supstanci u ćelijama; regulacija metabolizma; dio je nukleinskih kiselina i niza enzima; potrebno za formiranje ATP-a.
Fosfor se nalazi u tjelesnim tkivima i prehrambenim proizvodima u obliku fosforne kiseline i njenih organskih spojeva (fosfata). Njegova glavna masa je u koštanom tkivu u obliku kalcijum fosfata, ostatak fosfora je deo mekih tkiva i tečnosti. U mišićima se odvija najintenzivnija izmjena fosfornih spojeva. Fosforna kiselina je uključena u izgradnju molekula mnogih enzima, nukleinskih kiselina itd.
Uz dugotrajan nedostatak fosfora u ishrani, tijelo koristi vlastiti fosfor iz koštanog tkiva. To dovodi do demineralizacije kostiju i kršenja njihove strukture - razrjeđivanja. Kada je tijelo iscrpljeno fosforom, mentalna i fizička učinkovitost se smanjuje, primjećuje se gubitak apetita, apatija.
Dnevna potreba za fosforom za odrasle je 1200 mg. Povećava se kod velikog fizičkog ili psihičkog stresa, kod određenih bolesti.
Velika količina fosfora se nalazi u proizvodima životinjskog podrijetla, posebno u jetri, kavijaru, kao iu žitaricama i mahunarkama. Njegov sadržaj u ovim proizvodima kreće se od 100 do 500 mg na 100 g proizvoda. Žitarice (ovsene pahuljice, biserni ječam) su bogat izvor fosfora, sadrže 300-350 mg fosfora/100 g. Međutim, jedinjenja fosfora se apsorbuju iz biljnih proizvoda lošije nego kada se jedu hranu životinjskog porekla.
Sumpor. Važnost ovog elementa u ishrani determinisana je, prije svega, činjenicom da je dio proteina u obliku aminokiselina koje sadrže sumpor. (metionin i cistin), a također je sastavni dio nekih hormona i vitamina.
Kao komponenta aminokiselina koje sadrže sumpor, sumpor je uključen u procese metabolizma proteina, a potreba za njim se naglo povećava tokom trudnoće i rasta tijela, praćena aktivnim uključivanjem proteina u nastala tkiva, kao i tokom upalnih procesa. procesi. Aminokiseline koje sadrže sumpor, posebno u kombinaciji sa vitaminima C i E, imaju izražen antioksidativni učinak. Uz cink i silicijum, sumpor određuje funkcionalno stanje kose i kože.
Hlor. Ovaj element je uključen u stvaranje želučanog soka, formiranje plazme, aktivira brojne enzime. Ovaj nutrijent se lako apsorbira iz crijeva u krv. Zanimljiva je sposobnost hlora da se taloži u koži, zadržava u organizmu uz prekomerni unos i da se u značajnim količinama izlučuje znojem. Izlučivanje hlora iz organizma odvija se uglavnom urinom (90%) i znojem.
Poremećaji u razmjeni hlora dovode do razvoja edema, nedovoljnog lučenja želučanog soka itd. Oštar pad sadržaja hlora u organizmu može dovesti do ozbiljnog stanja, čak i smrti. Povećanje njegove koncentracije u krvi javlja se kada je tijelo dehidrirano, kao i kod kršenja funkcije izlučivanja bubrega.
Dnevna potreba za hlorom je oko 5000 mg. Hlor ulazi u ljudski organizam uglavnom u obliku natrijum hlorida kada se dodaje hrani.
^
3. Elementi u tragovima, njihove karakteristike
Iron. Ovaj element je neophodan za biosintezu spojeva koji osiguravaju disanje, hematopoezu; učestvuje u imunobiološkim i redoks reakcijama; dio je citoplazme, ćelijskih jezgara i brojnih enzima.
Asimilaciju gvožđa sprečavaju oksalna kiselina i fitin. Za asimilaciju ove hranjive tvari potreban je vitamin B 12. Askorbinska kiselina takođe doprinosi apsorpciji gvožđa, jer se gvožđe apsorbuje u obliku dvovalentnog jona.
^ Nedostatak gvožđa u organizmu može dovesti do razvoja anemije, izmene gasova, ćelijskog disanja, odnosno do poremećaja osnovnih procesa koji obezbeđuju život. Nastanak stanja nedostatka gvožđa olakšavaju: nedovoljan unos gvožđa u organizam u asimiliranom obliku, smanjenje sekretorne aktivnosti želuca, nedostatak vitamina (posebno B 12 , folna i askorbinska kiselina) i niz bolesti koje uzrokuju gubitak krvi.
Potrebe za gvožđem odrasle osobe (14 mg/dan) suvišno su zadovoljene normalnom ishranom. Međutim, kada se u ishrani koristi hljeb od finog brašna koji sadrži malo željeza, nedostatak željeza se vrlo često uočava kod urbanih stanovnika. Pri tome treba uzeti u obzir da proizvodi od žitarica bogati fosfatima i fitinom tvore teško rastvorljiva jedinjenja sa gvožđem i smanjuju njegovu asimilaciju u organizmu.
Gvožđe je rasprostranjen element. Nalazi se u iznutricama, mesu, jajima, pasulju, povrću, bobičastom voću. Međutim, u lako svarljivom obliku, željezo se nalazi samo u mesnim proizvodima, jetri (do 2000 mg / 100 g proizvoda), žumanjku.
Bakar. Bakar je esencijalni element u ljudskom metabolizmu, igra ulogu u formiranju crvenih krvnih zrnaca, oslobađanju gvožđa iz tkiva i razvoju skeleta, centralnog nervnog sistema i vezivnog tkiva.
Budući da je bakar široko rasprostranjen u hrani, malo je vjerovatno da će ljudi, s mogućim izuzetkom dojenčadi, na čisto mliječnoj prehrani, ikada razviti oblik pothranjenosti uzrokovane bakrom.
Konzumacija pretjerano velikih doza bakra od strane osobe dovodi do iritacije i erozije sluzokože, širokog oštećenja kapilara, oštećenja jetre i bubrega i iritacije centralnog nervnog sistema. Dnevna potreba za ovim elementom je oko 2 mg. Izvori bakra su namirnice kao što su jetra, žumance, zeleno povrće.
Jod. Jod je esencijalni element uključen u stvaranje hormona tiroksina. S nedostatkom joda razvija se gušavost - bolest štitne žlijezde.
Potreba za jodom kreće se od 100-150 mcg dnevno. Sadržaj joda u namirnicama je obično nizak (4-15 µg%). Plodovi mora su najbogatiji jodom. Tako ga u morskoj ribi ima oko 50 mcg/100 g, u jetri bakalara do 800, u algi, ovisno o vrsti i vremenu sakupljanja, od 50 mcg do 70.000 mcg/100 g proizvoda. Ali mora se uzeti u obzir da se tokom dugotrajnog skladištenja i termičke obrade hrane gubi značajan dio joda (od 20 do 60%).
Sadržaj joda u kopnenim biljnim i životinjskim proizvodima u velikoj mjeri ovisi o njegovoj količini u tlu. U područjima gdje ima malo joda u tlu, njegov sadržaj u prehrambenim proizvodima može biti 10 do 100 puta manji od prosjeka. Dakle, na ovim prostorima za prevenciju gušavosti kuhinjskoj soli se dodaje mala količina kalijum jodata (25 mg na 1 kg soli). Rok trajanja takve jodirane soli nije duži od 6 mjeseci, jer jod postepeno nestaje tokom skladištenja soli.
Fluor. U nedostatku ovog elementa nastaje zubni karijes (razaranje zubne cakline). Višak fluora također negativno djeluje na organizam, jer soli fluora, akumulirajući se u kostima, uzrokuju promjenu boje i oblika zuba, osteohondrozu, a nakon toga grubost zglobova i njihova nepokretnost, koštane izrasline. Razlika između korisnih i štetnih doza fluora je toliko mala da se mnogi istraživači protive fluorizaciji vode.
Fluor koji se konzumira s vodom gotovo se potpuno apsorbira, a fluor sadržan u hrani apsorbira se u manjoj mjeri. Apsorbirani fluor se ravnomjerno raspoređuje po cijelom tijelu. Zadržava se uglavnom u skeletu, a mala količina se deponuje u zubnom tkivu. U visokim dozama, fluor može uzrokovati kršenje metabolizma ugljikohidrata, lipida, proteina, kao i metabolizma vitamina, enzima i mineralnih soli.
Procjene dnevnog unosa fluorida iz hrane su napravljene u raznim zemljama; za odrasle ova vrijednost varira od 0,2 do 3,1 mg, a za djecu u starosnoj grupi od 1 do 3 godine unos fluorida je procijenjen na 0,5 mg/dan.
Gotovo svi prehrambeni proizvodi sadrže najmanje količine ovog elementa u tragovima. Sve vrste vegetacije sadrže određenu količinu fluora koji dobijaju iz tla i vode. Visok nivo fluora pronađen je u određenim namirnicama, posebno u ribi, nekom povrću i čaju. Upotreba fluorirane vode u postrojenjima za preradu hrane često može udvostručiti nivo fluora u gotovim proizvodima.
Za prevenciju i liječenje zubnog karijesa koriste se razne paste za zube, puderi, eliksiri, žvakaće gume i dr., koji sadrže fluor koji im se dodaje, uglavnom u neorganskom obliku. Ova jedinjenja se obično ugrađuju u paste za zube, obično u koncentracijama od oko 1 g/kg.
Chromium. Čini se da je ovaj element neophodan za metabolizam glukoze i lipida i za korištenje aminokiselina u nekim sistemima. Važan je i za prevenciju lakših oblika dijabetesa i ateroskleroze kod ljudi.
Krom se apsorbira i iz gastrointestinalnog trakta i iz respiratornog trakta. Apsorbovana količina nije ista za svaki od ovih sistema i zavisi od oblika hroma. Trovalentni hrom je esencijalni oblik elementa za ljude, heksavalentni hrom je toksičan. Krom se distribuira po tkivima ljudskog tijela u nejednakim, ali obično niskim koncentracijama. Nivo hroma u svim tkivima osim u plućima opada sa godinama. Najveće količine hroma kod ljudi akumuliraju se u koži, mišićima i masnom tkivu. Homeostatski mehanizmi, uključujući mehanizme transporta u jetri i crijevima, sprječavaju prekomjerno nakupljanje trovalentnog hroma. Krom se polako izlučuje iz organizma, uglavnom urinom.
Danas se smatra da je norma konzumacije oko 150 mg hroma dnevno. Posebno je koristan za starije osobe čije tijelo slabo apsorbira ugljikohidrate, a hrom pospješuje metaboličke procese ovih jedinjenja. Neorganski krom se slabo, mnogo lakše apsorbira - u organskim spojevima, odnosno u obliku u kojem se nalazi u živim organizmima.
Prehrambeni proizvodi značajno variraju u nivoima hroma, koji se kreću od 20 do 550 µg/kg. Bogati izvori hroma su pivski kvasac, jetra (10-80 mcg/100 g). U manjim količinama ovaj element se nalazi u krompiru sa ljuskom, govedini, svežem povrću, integralnom hlebu, siru.
Mangan. Mangan je neophodan kao kofaktor u brojnim enzimskim sistemima; igra ulogu u pravilnom funkcionisanju flavoproteina, u sintezi sulfatiranih mukopolisaharida, holesterola, hemoglobina i u mnogim drugim metaboličkim procesima. Od unesenog mangana, samo oko 3% se apsorbira.
Apsorpcija mangana je usko povezana sa apsorpcijom gvožđa. Potreba za manganom je 0,2-0,3 mg na 1 kg ljudske težine dnevno. Najviše mangana ima u brusnicama i čaju, nešto manje u kestenima, kakau, povrću, voću (100-200 mcg/100 g).
^ Nickel. Nikl je relativno nedavno prepoznat kao esencijalni element u tragovima. Trenutno je utvrđena njegova uloga kao koenzima u procesima metabolizma gvožđa. Istovremeno, povećanje unosa gvožđa u organizam je praćeno povećanjem potrebe za niklom za hranu. Osim toga, nikl doprinosi apsorpciji bakra - još jednog elementa neophodnog za hematopoezu. Važnost prehrambenog nikla ili nikla izolovanog iz prirodnih proizvoda naglašena je činjenicom da su sintetička jedinjenja ovog elementa kancerogena.
Nikl je prisutan u većini namirnica, ali u koncentracijama ispod (a često i mnogo ispod) 1 mg/kg. Prijavljeno je da se unos nikla ishranom kreće od manje od 200 do 900 µg/dan. Uz normalnu ishranu dolazi oko 400 mcg dnevno. Pokazalo se da je sadržaj nikla u vinu 100 i pivu 50 µg/L.
Cink. Ovaj element u tragovima kao koenzim učestvuje u širokom spektru reakcija biosinteze proteina (više od 70) i metabolizma nukleinskih kiselina (uključujući procese replikacije i transkripcije DNK), koje prvenstveno osiguravaju rast i pubertet organizma. Istovremeno, cink je, uz mangan, specifičan element u tragovima koji utiče na stanje seksualne funkcije, odnosno na aktivnost nekih polnih hormona, spermatogenezu, razvoj muških spolnih žlijezda i sekundarne spolne karakteristike. Osim toga, nedavno se razmatra uloga cinka u prevenciji hipertrofičnih procesa u prostati.
Cink, zajedno sa sumporom, učestvuje u rastu i obnavljanju kože i kose. Uz mangan i bakar, cink značajno doprinosi percepciji okusa i mirisa. Cink je kao nezaobilazna komponenta dio molekule inzulina, a njegov nivo je smanjen kod pacijenata sa šećernom bolešću. Vrlo je važno da je ovaj element u tragovima koenzim alkohol dehidrogenaze, koji osigurava metabolizam etil alkohola. Istovremeno, nivo apsorpcije cinka kod hroničnog alkoholizma naglo je smanjen. Takozvano "noćno sljepilo" (tj. oštećenje noćnog vida) može se razviti ne samo u nedostatku vitamina A, već i cinka. Cink, zajedno sa vitaminom B 6, osigurava metabolizam nezasićenih masnih kiselina i sintezu prostaglandina.
Cink je veoma važan za varenje i apsorpciju hranljivih materija. Dakle, cink osigurava sintezu najvažnijih probavnih enzima u pankreasu, a također sudjeluje u stvaranju hilomikrona - transportnih čestica, u kojima se masti iz ishrane mogu apsorbirati u krv. Cink je, uz vitamine B, važan regulator funkcija nervnog sistema. U uslovima nedostatka cinka mogu se javiti emocionalni poremećaji, emocionalna nestabilnost, razdražljivost, au veoma teškim slučajevima i disfunkcija malog mozga. Konačno, sve više podataka se akumulira u prilog sudjelovanju cinka u procesima sazrijevanja limfocita i reakcijama ćelijskog imuniteta.
Dnevne potrebe za cinkom su 8000-22000 mcg%. Sasvim je zadovoljna uobičajenom ishranom. Prosječan dnevni unos cinka samo s vodom za piće je oko 400 mcg. Sadržaj cinka u prehrambenim proizvodima obično se kreće od 150-25000 mcg%. Međutim, u jetri, mesu i mahunarkama dostiže 3000 - 5000 mcg%. Ponekad, nedostatak cinka može iskusiti organizam djece i adolescenata koji ne konzumiraju dovoljno životinjskih proizvoda.
^ Selen. Čak i sredinom XX veka. Nauka o ishrani selen ne samo da nije razmatrala, već se čak smatrao vrlo toksičnim elementom s kancerogenim svojstvima. Međutim, već 60-ih godina. ustanovljeno je da sa nedostatkom selena, kardiovaskularni sistem pati, koja se manifestuje progresivnom aterosklerozom i slabošću srčanog mišića, a u uslovima hroničnog nedostatka selena može se razviti gotovo neizlečiva kardiomiopatija. Nedavno je na nivou savremenih istraživanja potvrđeno jedno od važnih zapažanja drevne kineske medicine, koje ukazuje da adekvatna opskrba tijela selenom pomaže u usporavanju procesa starenja i vodi do dugovječnosti . Zanimljivo je napomenuti da su poznate ljekovite sorte zelenog čaja, koje su se snabdijevale carskim palačama u staroj Kini radi postizanja zdravlja i dugovječnosti, uzgajale u tim planinskim provincijama u čijim se tlima već sada utvrđuje visok sadržaj selena savremenim analitičkim metodama. .
Nakon otkrića selena, ustanovljeno je da vitamin E i selen djeluju na različite dijelove istog procesa i da su međusobno striktno komplementarni, odnosno da se njihova antioksidativna aktivnost dramatično povećava kada se koriste zajedno. Sinergija oba antioksidansa je od posebnog interesa u kontekstu antikancerogenog djelovanja. Tako se pokazalo da primena preparata selena istovremeno sa vitaminom E značajno povećava antikancerogeno dejstvo u odnosu na eksperimentalne tumore.
Unos selena hranom zavisi od uslova i prirode unosa hrane i nivoa selena u prehrambenim proizvodima. Povrće i voće su generalno loš izvor selena, za razliku od žitarica, proizvoda od žitarica, mesa (posebno nusproizvoda), morskih plodova koji sadrže značajne količine selena, tipično preko 0,2 mg/kg mokre težine . Hemijski sastav zemljišta i sadržaj selena u njemu značajno utiču na količinu selena u zrnu, koja varira od 0,04 mg/kg do 21 mg/kg.
molibden. Ukupna količina molibdena u tijelu odrasle osobe je oko 7 mg. Sadržaj molibdena u krvi je oko 0,5 mikrograma na 100 ml. Veće koncentracije ovog elementa pronađene su kod ljudi koji žive u regijama gdje je tlo najbogatije spojevima ovog metala. Tako su u nekim regijama Armenije zabilježeni česti slučajevi gihta među stanovnicima koji jedu uglavnom lokalne proizvode, u kojima je pronađen izuzetno visok nivo molibdena. Njegov sadržaj u ishrani stanovnika ovog kraja bio je 10-15 mg. U drugim područjima gdje su slučajevi gihta bili rjeđi, ljudi su dobivali samo 1-2 mg molibdena dnevno iz hrane.
Molibden je sastavni dio niza enzima, kao što su ksantin oksidaza, aldehid oksidaza, sulfat oksidaza. Poznato je da molibden inhibira razvoj karijesa.
Procijenjena dnevna potreba za molibdenom je 2 mcg po 1 kg tjelesne težine. U Rusiji dnevni unos molibdena iznosi 0,27 mg.
Najbogatije molibdenom su razne vrste povrća (npr. mahunarke) i unutrašnji organi životinja.
Kobalt. Biološki efekat kobalta poznat je od 1948. godine, kada su naučnici Rickes i Smith otkrili da je atom kobalta centralni u molekulu vitamina B 12. Maksimalna koncentracija kobalta u tkivima je oko 100 μg/kg. Ukupan sadržaj kobalta u tijelu odrasle osobe je 5 mg. Osoba sa hranom dnevno prima 5,63 -7,94 mikrograma kobalta, od čega se apsorbuje 73 - 97%.
Prosječna dnevna potreba za kobaltom je 60 mcg po 1 kg tjelesne težine. Smatra se da je osobi potreban kobalt samo u obliku cijanokobalamina (vitamin B 12). U nekim zemljama, jedinjenja kobalta se koriste kao aditivi za hranu pivu za stabilizaciju pjene. Međutim, pokazalo se da je takav aditiv uzrok srčanih bolesti kod konzumenata piva. Stoga je upotreba spojeva kobalta kao aditiva za hranu sada napuštena.
^
4 Uticaj prerade na mineralni sastav namirnica
Prilikom prerade prehrambenih sirovina u pravilu dolazi do smanjenja sadržaja mineralnih tvari (osim Na, dodanog u obliku soli za hranu). U biljnoj hrani se gube sa otpadom. Tako se smanjuje sadržaj niza makro-, a posebno mikroelemenata u proizvodnji žitarica i brašna nakon prerade zrna, jer ovih komponenti ima više u uklonjenim ljuskama i klicama nego u cijelom zrnu. U nastavku je data komparativna analiza mineralnog sastava pšeničnog brašna najvišeg kvaliteta i brašna od integralnih žitarica (sadržaj elemenata je naznačen u mg/100 g proizvoda):

Na primjer, zrno pšenice i raži u prosjeku sadrži oko 1,7% elemenata pepela, dok u brašnu, u zavisnosti od sorte, od 0,5 (u najvišem razredu) do 1,5% (u integralnom zrnu). Prilikom čišćenja povrća i krompira gubi se 10 do 30% minerala. Ako se podvrgnu termičkom kuhanju, tada se, ovisno o tehnologiji (kuhanje, prženje, dinstanje), gubi još 5 do 30%.
Meso, riblji proizvodi i perad uglavnom gube makronutrijente kao što su kalcij i fosfor tokom odvajanja pulpe od kostiju.
Prilikom termičkog kuhanja (kuhanje, prženje, dinstanje) meso gubi od 5 do 50% minerala. Međutim, ako se obrada provodi u prisustvu kostiju koje sadrže mnogo kalcija, moguće je povećati sadržaj kalcija u kuhanim mesnim proizvodima za 20%.
U tehnološkom procesu, zbog nedovoljno kvalitetne opreme, određena količina mikroelemenata može preći u konačni proizvod. Dakle, kada pravite hleb tokom pripreme tijesta kao rezultat kontakta tijesta sa opremom sadržaj gvožđa se može povećati za 30%. Ovaj proces je nepoželjan, jer toksični elementi sadržani u obliku nečistoća u metalu također mogu proći u proizvod zajedno sa željezom. Prilikom skladištenja konzervirane hrane u prefabrikovanim (tj. zalemljenim) konzervama sa nekvalitetnim lemom ili ako je zaštitni sloj laka pokvaren, u proizvod mogu proći visoko toksični elementi poput olova, kadmija i kalaja.
Treba uzeti u obzir da brojni metali, poput željeza i bakra, čak i u malim koncentracijama, mogu uzrokovati neželjenu oksidaciju proizvoda. Njihova katalitička oksidaciona sposobnost posebno je izražena u odnosu na masti i masne proizvode. Tako, na primjer, pri koncentraciji gvožđa iznad 1,5 mg/kg i bakra od 0,4 mg/kg tokom dugotrajnog skladištenja putera i margarina, ovi metali izazivaju užeglost proizvoda. Prilikom skladištenja pića u prisustvu gvožđa iznad 5 mg/l i bakra 1 mg/l, pod određenim uslovima, često se može primetiti zamućenje pića.
^
5. Metode za određivanje mineralnih materija
Za analizu mineralnih materija uglavnom se koriste fizičko-hemijske metode - optičke i elektrohemijske.
Gotovo sve ove metode zahtijevaju posebnu pripremu uzoraka za analizu, koja se sastoji u preliminarnoj mineralizaciji predmeta proučavanja. Mineralizacija se može izvesti na dva načina: "suvo" i "mokro". „Suha“ mineralizacija uključuje ugljenisanje, spaljivanje i kalciniranje testnog uzorka pod određenim uslovima. „Mokra“ mineralizacija podrazumeva i tretman predmeta proučavanja koncentrisanim kiselinama (najčešće HNO 3 i H 2 SO 4).
^ Spektralne metode analize.
Fotoelektrokolorimetrija - analiza zasnovana na merenju apsorpcije obojenih rastvora monohromatskog zračenja u vidljivom delu spektra. Mjerenja se provode pomoću fotoelektričnih kolorimetara opremljenih uskopojasnim filterima. Ako ispitivana tvar nije obojena, mora se kemijskom reakcijom s određenim reagensima pretvoriti u obojeno jedinjenje (fotometrijska analitička reakcija).
Spektrofotometrija je metoda analize zasnovana na mjerenju apsorpcije monokromatskog zračenja u ultraljubičastim, vidljivim i infracrvenim područjima spektra. Takva mjerenja se provode pomoću spektrofotometara, gdje se kao monokromatizatori koriste disperzivne prizme i difrakcijske rešetke.
Kvantitativna analiza jona koji se proučava obično se provodi metodom kalibracione krive.
Emisiona spektralna analiza. Metode emisione spektralne analize zasnivaju se na mjerenju talasne dužine, intenziteta i drugih karakteristika svjetlosti koju emituju atomi i joni tvari u plinovitom stanju. Emisiona spektralna analiza omogućava određivanje elementarnog sastava neorganskih i organskih supstanci.
Intenzitet spektralne linije je određen brojem pobuđenih atoma u izvoru pobude, koji ne zavisi samo od koncentracije elementa u uzorku, već i od uslova pobude. Uz stabilan rad izvora pobude, odnos između intenziteta spektralne linije i koncentracije elementa (ako je dovoljno niska) je linearan, odnosno u ovom slučaju se može izvršiti i kvantitativna analiza pomoću kalibracione krivulje. metoda.
Najveću primjenu kao izvor pobude dobio je električni luk, iskra, plamen. Temperatura luka dostiže 5000 - 6000°C. U luku je moguće dobiti spektar gotovo svih elemenata. S iskričnim pražnjenjem razvija se temperatura od 7000 - 10000 ° C i svi elementi se pobuđuju. Plamen daje dovoljno svijetao i stabilan emisioni spektar. Metoda analize koja koristi plamen kao izvor pobude naziva se analiza emisije plamena. Ovom metodom se utvrđuje više od četrdeset elemenata (zemnoalkalne i zemnoalkalne, Cu 2 , Mn 2 itd.).
^ Atomska apsorpciona spektroskopija . Metoda se zasniva na sposobnosti slobodnih atoma elemenata u plamenim gasovima da apsorbuju svetlosnu energiju na talasnim dužinama karakterističnim za svaki element.
U atomskoj apsorpcionoj spektroskopiji, mogućnost preklapanja spektralnih linija različitih elemenata gotovo je potpuno isključena, jer je njihov broj u spektru mnogo manji nego u emisionoj spektroskopiji.
Smanjenje intenziteta rezonantnog zračenja u uslovima atomske apsorpcione spektroskopije podleže eksponencijalnom zakonu smanjenja intenziteta u zavisnosti od debljine sloja i koncentracije supstance, slično Bouguer-Lambert-Beerovom zakonu
Konstantnost debljine sloja koji apsorbira svjetlost (plamen) postiže se pomoću gorionika posebnog dizajna. Metode atomske apsorpcione spektralne analize se široko koriste za analizu gotovo svakog tehničkog ili prirodnog objekta, posebno u slučajevima kada je potrebno odrediti male količine elemenata.
Metode za određivanje atomske apsorpcije razvijene su za više od 70 elemenata.
^ 2. Elektrohemijske metode analize.
Ionometrija. Metoda se koristi za određivanje K iona , N / A , Ca 2 , Mn 2 , F - , I - , Sl - itd.
Metoda se temelji na korištenju ionsko-selektivnih elektroda čija je membrana propusna za određenu vrstu jona (dakle, u pravilu, visoka selektivnost metode).
Kvantitativni sadržaj jona koji se utvrđuje vrši se ili pomoću kalibracionog grafika, koji je ucrtan u koordinatama E - pC, ili metodom sabiranja. Standardna metoda adicije preporučuje se za određivanje jona u složenim sistemima koji sadrže visoke koncentracije stranih supstanci.
Polarografija. Metoda polarografije naizmjenične struje koristi se za određivanje toksičnih elemenata (živa, kadmij, olovo, bakar, željezo).
Metoda se zasniva na proučavanju strujno-naponskih krivulja dobijenih tokom elektrolize elektrooksidirajuće ili elektroreducirajuće supstance. Kao indikatorska elektroda u polarografiji najčešće se koristi živina kap elektroda, ponekad čvrste mikroelektrode - platina, grafit. Kao referentna elektroda koristi se ili živa izlivena na dno elektrolizera ili zasićena polućelija kalomela.
Kako napon raste, dolazi trenutak kada se svi ioni koji ulaze u elektrodu zbog difuzije odmah isprazne i njihova koncentracija u sloju blizu elektrode postaje konstantna i praktično jednaka nuli. Struja koja teče u krugu u ovom trenutku naziva se struja ograničavanja difuzije.
Kvantitativna polarografska analiza temelji se na korištenju direktne proporcionalne ovisnosti difuzijske struje o koncentraciji elementa koji se utvrđuje.
^ MINERALNI ELEMENTI
Mineralni (pepeo) elementi se nalaze u prehrambenim proizvodima u obliku organskih i neorganskih jedinjenja. Nalaze se u mnogim organskim
tvari raznih klasa - proteini, masti, glikozidi, enzimi itd. Obično se mineralni elementi određuju u pepelu nakon sagorijevanja prehrambenih proizvoda, jer je prilično teško odrediti koje su točno tvari iu kojoj količini su ti elementi uključeni.
Uloga mineralnih elemenata u životu ljudi, životinja i biljaka je ogromna: svi fiziološki procesi u živim organizmima odvijaju se uz učešće ovih elemenata. Tako u ljudskom i životinjskom organizmu mineralni elementi učestvuju u plastičnim procesima, formiranju i izgradnji tkiva, u metabolizmu vode, u održavanju osmotskog pritiska krvi i drugih tjelesnih tekućina, u održavanju acidobazne ravnoteže u organizmu, i uključeni su u kompleks supstanci koje čine žive ćelije protoplazme, u sastav nekih endokrinih žlijezda itd.
Mineralni sastav organizama se mijenja s godinama; starenjem se uočava mineralizacija organizama. Dakle, novorođena djeca sadrže oko 34 g minerala na 1 kg tjelesne težine, kod odrasle osobe sadržaj ovih tvari raste na 43 g ili više.
Više od 70 mineralnih elemenata pronađeno je u ljudskom i životinjskom tijelu. Mnogi enzimski procesi koji se odvijaju u različitim tkivima tijela zahtijevaju učešće niza mineralnih elemenata. Dakle, za pretvaranje pirogrožđane kiseline u octenu kiselinu ili glukoze u fruktozu ili fosfoglicerola u glukozo-6-manozu-6- i fruktozo-6-fosfat, neophodno je učešće iona magnezijuma. Kalcijumovi joni inhibiraju razvoj ovog procesa.
Minerali su neravnomjerno raspoređeni u tkivima ljudskog tijela. U tvrdim tkivima dominiraju dvovalentni elementi: kalcijum (Ca) i magnezijum (Mg), au mekim tkivima monovalentni elementi: kalijum (K) i natrijum (Na). Osim toga, puno fosfora (P) se akumulira u tvrdim tkivima, uglavnom u obliku fosfatnih soli. Uz nedostatak minerala u hrani, ova jedinjenja se izlučuju iz organizma i narušava se normalan metabolizam.
Mineralne tvari otopljene u krvnoj plazmi, međućelijskoj i drugim tjelesnim tekućinama stvaraju određeni osmotski tlak, koji ovisi o molarnoj koncentraciji tvari otopljenih u tekućini. Soli povećavaju osmotski pritisak u većoj mjeri
stepena od neelektrolita pri istoj molarnoj koncentraciji, jer se soli disociraju i formiraju jone. Osmotski pritisak zavisi od ukupnog broja nedisociranih molekula i jona. Osmotski pritisak krvi, limfe i međustanične tekućine ljudskog i životinjskog tijela ovisi uglavnom o natrijum hloridu (NaCl) otopljenom u njima.
Osmotski pritisak u tjelesnim tekućinama utječe na distribuciju vode i otopljenih tvari u tkivima. Kod viših životinja osmotski pritisak je konstantan i iznosi 7,5 - 9,0 atm. Održavanje konstantnog osmotskog tlaka osigurava se aktivnošću organa za izlučivanje, uglavnom bubrega i znojnih žlijezda.
Ulazak mineralnih soli u krv dovodi do ulaska međustanične vode u krv, pa se koncentracija soli u krvi smanjuje. Višak vode i soli se zatim uklanjaju preko bubrega. Smanjenje količine vode u tkivima, refleksno djelujući na nervne centre, izaziva žeđ.
Normalna vitalna aktivnost ljudskog tijela može se odvijati samo uz određene osobine međućelijskih i intersticijskih tekućina. U ovoj postojanosti okoline, važnu ulogu igra kiselinsko-bazna ravnoteža, u kojoj je reakcija krvi, limfe i drugih tjelesnih tekućina bliska neutralnoj. Kiselinsko-bazna ravnoteža se održava zahvaljujući složenom sistemu regulatora, kombinovanih u jednu celinu od strane centralnog nervnog sistema. Takvi regulatori su puferski sistemi krvi, izmjena kisika i ugljičnog dioksida, ugljičnog dioksida i hloridnih soli, funkcije izlučivanja bubrega, pluća, znojnih žlijezda itd.
U procesu složene transformacije u ljudskom organizmu hrane bogate kalcijumom, magnezijumom, natrijumom ili kalijumom mogu nastati alkalna jedinjenja. Izvori elemenata koji stvaraju alkalije uključuju voće, povrće, mahunarke, mlijeko i mliječne proizvode.
Ostali proizvodi, kao što su meso, riba, jaja, sir, hleb, žitarice, testenine, u procesu transformacije u ljudskom organizmu daju kisela jedinjenja.
Priroda ishrane može uticati na promene kiselinsko-bazne ravnoteže u tkivima ljudskog tela. Kiselinsko-bazna ravnoteža se često pomera > stranu kiselosti. Kao rezultat oštrog pomaka
dozvoljeni maksimalni standardi za sadržaj pepela, a prilikom ocjenjivanja takvih proizvoda određuju njegovu količinu.
Obično se razlikuju dva koncepta - "ukupni (sirovi) pepeo" i "čisti pepeo". Pojam "ukupni pepeo" označava zbir mineralnih elemenata ili njihovih oksida koji su deo hemijske strukture prehrambenih proizvoda, kao i uneti u proizvod tokom njegove proizvodnje ili "slučajno zahvaćeni kao nečistoće". "Čisti pepeo" označava zbir mineralnih elemenata ili njihovih oksida bez nečistoća.
Sadržaj pepela u proizvodu određuje se sagorevanjem. Da biste to učinili, uzorak se prvo pažljivo spaljuje, a zatim kalcinira do konstantne težine. Povećana količina pepela u odnosu na normu ukazuje na kontaminaciju proizvoda pijeskom, metalnim česticama i zemljom.
Da bi se odredio "čisti pepeo", nastali pepeo se tretira sa 10% hlorovodoničnom kiselinom. U ovom slučaju, "čisti pepeo" se otapa u hlorovodoničnoj kiselini, a ostatak će ukazivati na prisustvo stranih anorganskih nečistoća u proizvodu. Dakle, u slučaju lošeg pranja paradajza prije prerade ili u krumpirovom škrobu, uz nedovoljno pranje gomolja, atomski proizvod sadrži povećanu količinu pepela zbog stranih mineralnih nečistoća.
Kalcijum u ljudskom tijelu nalazi se u koštanom tkivu i zubima – oko 99%. Ostatak kalcija ulazi u krv u obliku jona iu stanju povezanom s proteinima i drugim spojevima.
Dnevna potreba odrasle osobe za kalcijumom je 0,8-1,0 g. Trudnicama i dojiljama su potrebne povećane količine kalcijuma, do 1,5-2 g dnevno, kao i djeci u čijim se organima kalcijum intenzivno koristi za formiranje kostiju. Nedostatak kalcija uzrokuje deformitet skeleta, krhkost kostiju i atrofiju mišića u tijelu. Kalcijum se odlikuje osobinom da se čak i uz nedostatak u hrani nastavlja da se izlučuje iz organizma u značajnim količinama.
Kalcij se nalazi u prehrambenim proizvodima u obliku fosfatnih i oksalat hloridnih soli, kao iu kombinaciji sa masnim kiselinama, proteinima itd.
Sva jedinjenja kalcijuma, sa izuzetkom CaC!a, teško su rastvorljiva u vodi, pa se zbog toga slabo apsorbuju
ljudsko tijelo. Nerastvorljiva jedinjenja kalcijuma delimično prelaze iz proizvoda u rastvor u želucu pod dejstvom hlorovodonične kiseline želudačnog soka. Apsorpcija kalcijuma iz prehrambenih proizvoda od strane ljudskog organizma u velikoj meri zavisi od prisustva u hrani fosfata, masti, jedinjenja magnezijuma itd. Dakle, apsorpcija kalcijuma je najveća kada je odnos kalcijuma i fosfora I u hrani ; 1,5 ili 1:2. Povećana količina fosfora u hrani u odnosu na naznačene omjere dovodi do naglog smanjenja apsorpcije kalcija. Višak magnezijuma takođe negativno utiče na apsorpciju kalcijuma od strane ljudskog tela. Oštro negativan učinak na apsorpciju kalcija imaju spojevi kalcija s inozitol-fosfornom kiselinom, koja se u značajnim količinama nalazi u zrnu žitarica i proizvodima njegove prerade.
Vitamin D igra vrlo važnu ulogu u apsorpciji kalcija, što pospješuje prelazak soli kalcija i fosfora iz crijeva u krv i taloženje u kostima u obliku kalcijum fosfata.
Sadržaj kalcijuma u nekim prehrambenim proizvodima je sledeći (mg%): u nemasnom mesu - 7; u jajima - 54; u mleku - 118; u siru - 930; u svježem siru - 140; u ovsenim pahuljicama - 65; u pšeničnom brašnu - 15; u pirinču - 9; u jabukama - 7; u narandžama - 45; u orasima -89; u cvekli - 29; u karfiolu - 89; u bijelom kupusu - 45; u šargarepi - 56; kod krompira - 14. Iz navedenih podataka se vidi da su najvažniji izvor kalcijuma za čoveka mlečni proizvodi. Kalcij u mliječnim proizvodima, kao i povrću i voću, je lako probavljivo jedinjenje.
Magnezijuma u ljudskom organizmu je 30-35 puta manje od kalcijuma, ali je veoma važan. Najviše magnezijuma nalazi se u koštanom tkivu. Magnezijum ima posebnu ulogu u biljkama koje nose hlorofil, gde je deo molekula hlorofila. Kao i kalcijum, magnezijum formira teško rastvorljiva jedinjenja. Magnezijum je posebno teško asimilirati u prisustvu LO$ jona.
Sadržaj magnezijuma u nekim prehrambenim proizvodima je sledeći (mg%): u pasulju - 139; u ovsenim pahuljicama - 133; u grašku - 107; u prosu - 87; u pšeničnom hlebu - 30; u krompiru - 28; u šargarepi - 21; u bijelom kupusu -!Ana - 12; u jabukama - 8; u limunu - 7; u govedini - 15; u jajima - 11; u mlijeku - 12. Shodno tome, 2*35 magnezijuma nalazi se u najvećim količinama u žitaricama i mahunarkama.
Potrebe za magnezijumom za odraslu osobu su 400 mg dnevno.
Natrijum se široko nalazi u hrani, posebno u proizvodima životinjskog porekla. Glavni izvor natrijuma za ljudsko tijelo je NaCt (obična sol). Natrijum ima važnu ulogu u procesima unutarćelijskog i međutkivnog metabolizma. Oko 90% osmotskog pritiska krvne plazme zavisi od sadržaja NaCl u njoj. Obično se 3,3 g natrijuma rastvori u litri ljudske krvne plazme. NaC! Takođe igra važnu ulogu u regulaciji metabolizma vode u tijelu. Joni natrija uzrokuju oticanje koloida tkiva i na taj način doprinose zadržavanju vezane vode u tijelu. Iz tijela NaC! izlučuje se uglavnom urinom i znojem. Sa povećanim radom i potrošnjom tečnosti, osoba gubi do 3-5 litara znoja, što je 99,5% vode. U suvoj materiji znoja, glavni deo je NaGI.
Kuhinjska so, koja u ljudski organizam ulazi s hranom, nadoknađuje potrošnju NaCl u krvi i koristi se za stvaranje hlorovodonične kiseline u želučanom soku, kao i za sintezu NaHCO3 u pankreasnoj žlijezdi. Prisutnost NaHCO3 objašnjava alkalnu reakciju soka pankreasa, koja je neophodna za razgradnju proteina hrane pomoću enzima tripsina.
Dnevna potreba odrasle osobe za natrijem je 4-6 g, što odgovara 10-15 g kuhinjske soli. Uobičajena prehrana stanovništva sadrži dovoljne količine natrijuma, jer se u hranu dodaje kuhinjska sol.
Kalijum je stalno iu značajnim količinama prisutan u prehrambenim proizvodima, posebno biljnog porekla.U pepelu biljaka sadržaj kalijuma je ponekad i preko 50% njegove mase.
U ljudskom tijelu, kalij je uključen u enzimske reakcije, formiranje puferskih sistema koji sprječavaju promjene u reakciji okoline. Kalijum smanjuje
sposobnost zadržavanja vode proteina, smanjujući njihovu hidro-(sposobnost), a samim tim podstiču izlučivanje vode i natrijuma iz organizma, pa se kalijum može smatrati nekim fiziološkim antagonistom natrijuma.
Dnevna potreba odrasle osobe za kalijumom je 3-5 g.
Gvožđe je široko rasprostranjeno u prirodi. Općenito, gotovo sva prirodna hrana sadrži željezo, ali u malim količinama.
U ljudskim i životinjskim organizmima gvožđe je deo najvažnijih organskih jedinjenja – hemoglobina u krvi, mioglobina, nekih enzima – katalaze, peroksidaze, citokrom oksidaze itd. Hemoglobin u krvi sadrži 2A, gvožđe organizma. Značajna količina gvožđa nalazi se u slezeni i jetri. Gvožđe ima sposobnost da se akumulira u organizmu. Hemoglobin u krvi se uništava tokom života, a gvožđe koje se oslobađa u ovom slučaju tijelo može ponovo iskoristiti za formiranje hemoglobina.
Gvožđe, koje se nalazi u sastavu voća i povrća, ljudski organizam dobro apsorbuje, dok je većina gvožđa u proizvodima od žitarica u neprobavljivom obliku za organizam.
Dnevna potreba žlijezde odraslog čovjeka je 15 mg.
L l o r je dio prirodne hrane u malim količinama. Biljni proizvodi sadrže malo hlora, dok proizvodi životinjskog porekla sadrže nešto više. Dakle, sadržaj hlora u govedini je 76 mg, u mleku - 106, u jajima -
37106, u siru - 880, u prosu - 19, u krompiru - 54, u jabukama - 5 mg%.
Sadržaj hlora je značajan u krvi i drugim tjelesnim tečnostima, kao iu koži, plućima i bubrezima. Hlor je u organizmu u jonizovanom stanju u obliku anjona soli natrijuma, kalijuma, kalcijuma, magnezijuma, mangana. Jedinjenja hlora u prehrambenim proizvodima su visoko rastvorljiva i lako se apsorbuju u ljudskom crevu. Anjoni hlora, zajedno sa kationima natrijuma, igraju važnu ulogu u stvaranju i regulaciji osmotskog pritiska krvi i drugih tjelesnih tekućina. Soli hlora obezbeđuju stvaranje hlorovodonične kiseline u želučanoj sluznici.
Glavnu potrebu za hlorom zadovoljava natrijum hlorid, koji se hrani dodaje u obliku soli.
Ukupna količina natrijum hlorida u ljudskom organizmu je obično 10-15 g, ali kada jedemo hranu bogatu solima hlora, sadržaj hlora u ljudskom organizmu može dostići i veću količinu. Dnevna ljudska potreba za hlorom je 5-7 g.
Sumpor se u najvećim količinama nalazi u proizvodima od žitarica, mahunarkama, mliječnim proizvodima, mesu, ribi, a posebno jajima. Sastoji se od gotovo svih proteina ljudskog tijela, a posebno je bogat aminokiselinama - cistinom, metioninom. Razmjena sumpora u tijelu je uglavnom njegova transformacija u naznačene aminokiseline. Također je uključen u stvaranje vitamina Bg (tiamina), inzulina i nekih drugih spojeva. Mnogo je sumpora u proteinoidima potpornih tkiva, na primjer, u keratinu kose, noktiju itd.
Kada se spojevi oksidiraju u tijelu, značajan dio sumpora se izlučuje urinom u obliku soli sumporne kiseline.
Dnevna potreba odrasle osobe za sumporom uz umjeren rad je oko 1 g.
Jod se nalazi u tijelu zdrave osobe težine 70 kg u količini od približno 25 mg. Polovina te količine nalazi se u štitnoj žlijezdi, a ostatak u mišićnom i koštanom tkivu te u krvi. Jod neorganskih jedinjenja u štitnoj žlezdi zamenjen je organskim jedinjenjima - tiroksinom, dijodtiroksinom, trijodtiroksinom. Jod se brzo apsorbira u štitnoj žlijezdi i nekoliko sati nakon ulaska u nju pretvara se u organski
veze. Ova jedinjenja stimulišu metaboličke procese u telu. Kada s hranom u organizam uđe nedovoljna količina joda, poremeti se aktivnost štitne žlijezde i nastaje ozbiljna bolest koja se zove endemska struma.
Najveća količina joda nalazi se u biljnim i životinjskim proizvodima priobalnih područja, gdje je koncentrisan u morskoj vodi, zraku i tlu priobalnih područja. Malo joda akumulira se u biljkama i životinjskim organizmima planinskih ili udaljenih od morske obale predjela joda.
Sadržaj joda u proizvodima od žitarica, povrću, slatkovodnoj ribi ne prelazi 5-8 mcg na 100 g sirovog proizvoda. Govedina, jaja, puter, voće odlikuju se većim sadržajem joda. Najveću količinu joda sadrže morski kelj, morska riba i riblje ulje. Plodovi feijoe koji rastu na crnomorskoj obali Gruzije akumuliraju do 390 mikrograma joda na 100 g voćne mase, što je mnogo više od sadržaja ovog elementa u drugom voću i povrću.
U područjima gdje prehrambeni proizvodi sadrže nedovoljne količine joda, kalijev jodid se dodaje kuhinjskoj soli u količini od 25 g K1 po toni kuhinjske soli. Uz normalnu ishranu, osoba dnevno unese 200 mikrograma joda sa jodiranom soli. Međutim, pri skladištenju jodirane soli jod postepeno nestaje, pa se nakon 6 mjeseci jodirana sol prodaje kao obična kuhinjska so.
Dnevna ljudska potreba za jodom je 100-260 mcg.
Fluor igra važnu ulogu u plastičnim procesima tokom formiranja koštanog tkiva i zubne cakline. Najveća količina fluora je koncentrisana u kostima - 200-490 mg/kg i zubima - 240-560 mg/kg.
Čini se da je voda glavni izvor fluorida u ljudskom tijelu, pri čemu se Dodin fluorid bolje apsorbira od fluorida iz hrane. Sadržaj fluora u vodi za piće kreće se od 1 do 1,5 mg/l. Nedostatak fluora u vodi često utiče
39nne do razvoja bolesti zuba, poznatog kao karijes. Višak fluora u vodi uzrokuje fluorozu, u kojoj se narušava normalna struktura zuba, pojavljuju se mrlje na caklini i povećava se krhkost zuba. Djeca posebno pate od nedostatka ili viška fluora.
Dnevna ljudska potreba za fluorom još nije utvrđena. Smatra se da bi optimalna količina fluora u vodi za piće za zdravlje trebala biti 0,5-1,2 mg/l.
Bakar u životinjskom organizmu, uz gvožđe, igra važnu ulogu u procesima hematopoeze, stimuliše oksidativne procese i stoga je povezan sa metabolizmom gvožđa. Dio je enzima (laktaza, askorbat oksidaza, citokrom oksidaza itd.) kao metalna komponenta.
U biljkama bakar pojačava oksidativne procese, ubrzava rast i povećava prinos mnogih kultura.
U onim malim količinama u kojima se bakar nalazi u prirodnim proizvodima, on ne šteti ljudskom tijelu. Ali povećane količine bakra mogu uzrokovati trovanje. Dakle, istovremeni unos 77-120 mg bakra može izazvati mučninu, povraćanje, a ponekad i dijareju. Stoga je sadržaj bakra u prehrambenim proizvodima reguliran važećim propisima Ministarstva zdravlja SSSR-a. Na 1 kg proizvoda, ovisno o sadržaju čvrstih tvari u njemu, dopušteno je od 5 do 30 mg bakra. Dakle, u koncentrovanoj pasti od paradajza sadržaj bakra ne bi trebao prelaziti 30 mg / kg, u paradajz pireu - 15-20, u konzerviranom povrću - 10, u pekmezu i marmeladi - 10, u voćnim kompotima - 5 mg / kg.
Bakar može dospjeti u prehrambene proizvode prilikom njihove proizvodnje - iz bakrenih dijelova opreme, pri tretiranju vinograda pesticidima koji sadrže bakar itd.
Dnevna potreba odrasle osobe za bakrom je 2 mg.
Cink se nalazi u svim tkivima životinja i biljaka. Sa nedostatkom cinka u organizmima mladih žena,
Kod biljaka je njihov rast odložen, a njegovim nedostatkom u tlu nastaju bolesti mnogih biljaka, što često dovodi do njihove smrti.
Cink je dio niza enzima, a posebno je važna njegova uloga u molekuli enzima karboanhidraze, koja je uključena u vezivanje i izlučivanje ugljičnog dioksida iz životinjskog tijela. Cink je neophodan za normalnu funkciju hormona hipofize, nadbubrežne žlijezde i pankreasa. Takođe utiče na metabolizam masti, povećavajući razgradnju masti i sprečavajući masnu jetru.
Cink u hrani u velikim količinama može uzrokovati trovanje. Kisela i masna hrana otapa metalni cink, te je stoga kuhanje ili čuvanje hrane u opremi ili posuđu od cinka neprihvatljivo. Trovanje cinkom je slično trovanju bakrom, ali je izraženije i praćeno je pečenjem i bolovima u ustima i želucu, povraćanjem, proljevom i slabošću srca. Posuđe od cinka dozvoljeno je samo za čuvanje hladne vode za piće, jer je u ovom slučaju rastvorljivost cinka zanemarljiva.
Dnevna potreba odrasle osobe za cinkom je 10-15 mg. Povećana potreba za cinkom uočava se tokom rasta i puberteta. Uz normalnu ishranu, osoba dobija dovoljnu količinu cinka iz hrane.
Olovo se u životinjskim i biljnim proizvodima nalazi u vrlo malim količinama. Dakle, u jabukama, kruškama, grožđu, jagodama sadržaj olova je oko 0,1 mg na 1 kg proizvoda, u mlijeku - 0,8, u mesu - 0,05, u jesetri - 0,06 mg na 1 kg.
Olovo je otrovan metal za ljude, ima sposobnost da se akumulira u organizmu, uglavnom u jetri, i izazove teška kronična trovanja.
Dnevnom upotrebom 2-4 mg olova uz hranu, znak trovanja olovom može se otkriti nakon nekoliko mjeseci.
41 Kontaminacija hrane olovom može biti od pribora, lemova, glazure, opreme i insekticida koji sadrže olovo. Do trovanja olovom najčešće dolazi kada se hrana skladišti u zanatskoj zemljanoj posudi koja nije dobro prekrivena olovnom glazurom.
Zbog visoke toksičnosti, sadržaj olova u prehrambenim proizvodima nije dozvoljen.
Kalaj se nalazi u prehrambenim proizvodima u malim količinama. Tako je u jetri bika i ovna pronađeno 0,14 mg/kg kalaja, u bubrezima 0,003, u plućima 0,63, a u mozgu 0,019 mg/kg.
Kalaj nije tako otrovan metal kao olovo, cink ili bakar, pa je dozvoljen u ograničenim količinama u opremi prehrambenih preduzeća, kao i za kalajisanje površine kalaja, od koje se pripremaju limenke, štiteći je od korozije. Međutim, često tijekom dugotrajnog skladištenja konzervirane hrane u limenkama, masa proizvoda stupa u interakciju s limenim premazom lima, zbog čega nastaju kositrene soli organskih kiselina. Ovaj proces je posebno aktivan kada se u konzervi nalaze proizvodi sa visokom kiselošću - voće, konzervirana riba i povrće u sosu od paradajza itd. Tokom dugotrajnog skladištenja, sadržaj kalaja u konzervi može značajno da poraste. Sadržaj kalaja posebno brzo raste u proizvodima koji se nalaze u otvorenim metalnim limenkama obloženim kalajem.
Da bi se poboljšala zaštita limenke od korozije, na površinu lima se dodatno nanose posebni kiselootporni lakovi ili emajl ili se na površini lima stvara tanak film stabilnih kalajnih oksida.
Mangan je široko rasprostranjen u životinjskim i biljnim proizvodima. Aktivno učestvuje u stvaranju mnogih enzima, formiranju kostiju, procesima hematopoeze i stimuliše rast. U biljkama mangan pospješuje proces fotosinteze i stvaranje askorbinske kiseline.
Biljni proizvodi su u većini slučajeva bogatiji manganom od životinjskih proizvoda. Dakle, sadržaj mangana u proizvodima od žitarica dostiže 1-15 mg po 1 kg, u listu
povrće - 10-20, u voću - 0,5-1, u mlijeku - 0,02-0,03, u jajima - 0,1-0,2, u jetri životinja - 2,65-2,98 mg po 1 kg.
Uz nedostatak mangana u tlu, biljke obolijevaju i slabo se razvijaju, smanjuje se prinos voća, povrća i drugih usjeva. Dodavanje mikrođubriva koja sadrže mangan zemljištu pomaže u povećanju prinosa.
Dnevna potreba odrasle osobe za manganom je 5-10 mg dnevno.
Radioaktivni izotopi su prisutni u ljudskom tijelu, kontinuirano ulaze i izlaze iz tijela. Postoji ravnoteža između unosa radioaktivnih jedinjenja u organizam i njihovog uklanjanja iz organizma. Svi prehrambeni proizvodi sadrže radioaktivne izotope kalija (K40), ugljika (C14), vodonika (H3), kao i radijuma sa njegovim produktima raspadanja.
Najveća koncentracija pada na kalij (K40). Izotopi sudjeluju u metabolizmu zajedno s neradioaktivnim.
Smatra se da u najbližem geološkom vremenu nije došlo do velikih promjena u intenzitetu zračenja na Zemlji, pa se u životinjskom i biljnom carstvu razvila svojevrsna imunost na ove nivoe radijacije. Ali živi organizmi su vrlo osjetljivi na povišene koncentracije. Male koncentracije povećavaju rast živih organizama, velike koncentracije uzrokuju pojavu aktivnih radikala, zbog čega dolazi do narušavanja vitalne aktivnosti pojedinih organa i tkiva, kao i cijelog organizma.
Nuklearne eksplozije oslobađaju radioaktivne izotope na površinu Zemlje, zagađujući atmosferu, vodu, tlo i biljke. Putem hrane, atmosfere i vode radioaktivni izotopi ulaze u ljudski organizam.
Utvrđeno je da kada se prehrambeni proizvodi tretiraju zračenjem radioaktivnih izotopa, njihov rok trajanja se produžava, a klijanje krompira odlaže. Ali obično, ozračena hrana može razviti specifičan miris i okus, a moguće je i stvaranje otrovnih tvari. Za utvrđivanje sigurnosti takvih proizvoda potrebni su dugoročni eksperimenti.
Kontrolna pitanja
Koji hemijski elementi su makronutrijenti?
Koje su funkcije minerala u ljudskom tijelu?
Koja je uloga kalcijuma u ljudskom tijelu?
Koji hemijski elementi se klasifikuju kao elementi u tragovima i koje su njihove funkcije u ljudskom telu?
Kakvu ulogu ima gvožđe u ljudskom organizmu i u kojoj hrani se nalazi?
Koje su posljedice nedostatka joda u organizmu i kako se to može izbjeći?
Koje vrste tehnološke obrade sirovina i prehrambenih proizvoda doprinose gubitku minerala?
Navedite primjere interakcije nekih mikroelemenata i vitamina.
Koje metode za određivanje sadržaja makro- i mikroelemenata poznajete?
Kukuškin lan se razmnožava: zoosporama;
sjeme pod nepovoljnim uvjetima;
sporovi; +
aplanospore.
- listovi jagode:
neupareni perasti;
ternarni; +
trostruki, jednolisni;
složena unifolija. Pčele radilice su:
aseksualne osobe;
ženke s nerazvijenim reproduktivnim organima; +
mužjaci sa nerazvijenim reproduktivnim organima;
mužjaci i ženke sa normalno razvijenim reproduktivnim organima, ali se privremeno ne razmnožavaju. Probava u koraljnim polipima:
samo šupljina;
samo intracelularno;
abdominalni i intracelularni; +
šupljina, unutarćelijska i vanjska. Pteropodni mekušci koji imaju sposobnost da svijetle u mraku mogu biti dio:
bentos;
neuston;
fitoplankton;
zooplankton. + Ciklus razvoja blowfly je prvi opisao:
Anton Levenguk;
Francesco Redi; +
Henri Fabre;
Louis Pasteur. Gusjenice leptira imaju:
tri para prsnih nogu;
tri para torakalnih nogu i pet pari ventralnih lažnih nogu; +
osam pari lažnih nogu;
udovi nedostaju. Cirkulacioni sistem lancete:
otvoren;
zatvoren, postoji jedan krug cirkulacije krvi; +
zatvorena, postoje dva kruga cirkulacije krvi;
odsutan. Odaberite tačne rečenice:
- Odaberite tačne rečenice:
- Kod ciklostoma, probavni trakt ima:
oblik ravne cijevi;
izraslina jetre;
pilorične izrasline;
spiralni ventil. + Od riba reda jesetra nije prolazni pogled:
beluga;
zvjezdasta jesetra;
sterlet; +
jesetra. Žlijezde slinovnice tokom evolucije kičmenjaka prvi put se pojavljuju u:
lungfish;
vodozemci; +
gmizavci;
sisari. Od riba iz reda bakalara živi i mrijesti se samo u slatkovodnim tijelima:
bakalar;
vahnja;
burbot; +
pollock. Porijeklo ptičjeg krila iz slobodnog prednjeg uda karakterističnog za četveronožne kralježnjake jasno je ilustrovano primjerom pilića:
noj;
kivi;
hoatzin; +
pingvin. O aerodinamičkim svojstvima ptice u letu ne utiču perje:
zamašnjaci;
paperjast; +
upravljanje;
kontura. Kod ptica stereoskopski vid je najrazvijeniji kod vrsta:
insektivori;
granivorous;
mesožder; +
planktivorous.
Glikokaliks životinjskih ćelija formira:
proteini i lipidi;
proteini i nukleotidi;
proteini i ugljikohidrati; +
ugljikohidrati i nukleotidi.
Proces kojim dizenterična ameba proguta crvena krvna zrnca:
osmoza;
pinocitoza;
fagocitoza; +
olakšanu difuziju.
Ostaci pitekantropa prvi put su otkriveni u:
Južna Afrika;
Australija;
Centralna Azija;
Jugoistočna Azija. +
Najstariji od navedenih fosilnih predaka čovjeka je:
neandertalac;
Pithecanthropus;
Australopithecus; +
Kromanjonac.
Organele koje se nalaze u ćelijama i prokariota i eukariota:
endoplazmatski retikulum;
mitohondrije;
lizozomi;
ribozomi. +
Glavne komponente eukariotskog nuklearnog hromatina su:
DNK i RNK;
RNK i proteini;
DNK i proteini; +
DNK i lipidi. mikrotubule ne pružaju:
održavanje oblika ćelije;
promjena oblika ćelije; +
kretanje organela;
kretanje hromozoma tokom deobe ćelije. Ćelijski proteini namenjeni za lučenje sortiraju se i pakuju u:
lizozomi;
endosomi;
endoplazmatski retikulum;
trans Golgi mreže. +
Lokacija enzima ATP sintetaze u mitohondrijima je:
matrica;
intermembranski prostor;
vanjska membrana;
unutrašnja membrana. +
Oksidacija organskih jedinjenja do CO 2 u mitohondrijima se dešava:
u matrici; +
u intermembranskom prostoru;
na vanjskoj membrani;
na unutrašnjoj membrani.
Antikodon sadrži:
jedan nukleotid;
dva nukleotida;
tri nukleotida; +
četiri nukleotida.
Konačni akceptor elektrona u ćelijskom disanju je:
NADH;
voda;
kiseonik; +
ATP.
Svojstvo genetskog koda koje povećava pouzdanost skladištenja i prijenosa genetskih informacija:
trojka;
univerzalnost;
redundantnost; +
nedostatak znakova interpunkcije.
Joni magnezijuma su deo:
hemoglobin;
insulin;
hlorofil; +
tiroksin. Molekule RNK sposobne da ispolje katalitičku aktivnost nazivaju se:
ribonukleaze;
ribosomi;
ribozimi; +
ribonukleotidi. Makroergijska jedinjenja se nazivaju:
karakterizira prisustvo kovalentnih veza s visokom energijom;
u razaranju određenih veza u kojima se oslobađa velika količina slobodne energije; +
čija se sinteza odvija uz utrošak velike količine energije;
koji pri sagorevanju daju mnogo toplote.
U procesu fotosinteze, izvor kisika kao nusproizvoda je:
ribuloza bisfosfat;
glukoza;
voda; +
ugljen-dioksid.
Razvoj nitrificirajućih bakterija dovodi do:
zakiseljavanje životne sredine; +
alkalizacija okoline;
neutralizacija životne sredine;
ne utiče na pH podloge.
Acidofil nastaje kao rezultat fermentacije mlijeka:
bakterije mliječne kiseline; +
kvasac;
miješana kultura bakterija mliječne kiseline i kvasca;
miješana kultura bakterija mliječne kiseline i propionske kiseline.
Od ovih bolesti, izaziva ga virus:
kolera;
male boginje; +
kuga;
malarija.
Od komponenti biljnih ćelija, virus mozaika duhana inficira:
mitohondrije;
kloroplasti; +
jezgro;
vakuole.